Из чего состоит молекула?
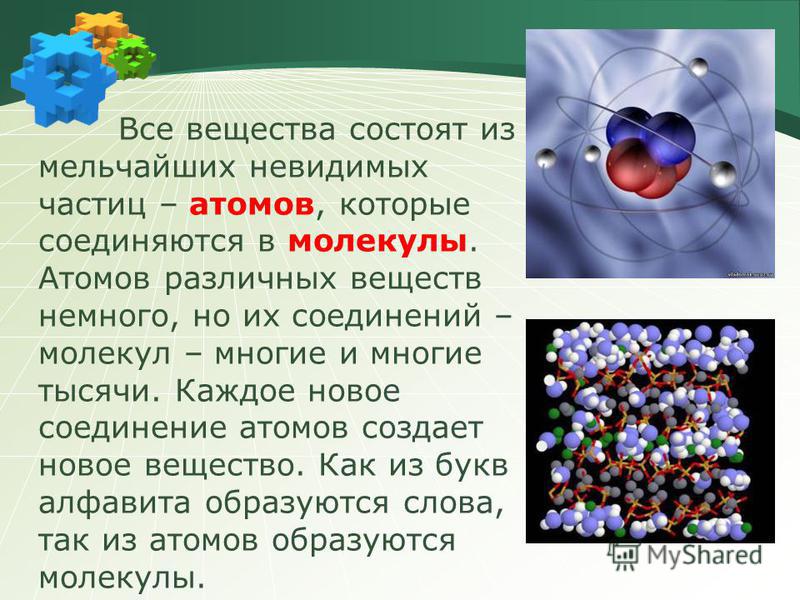
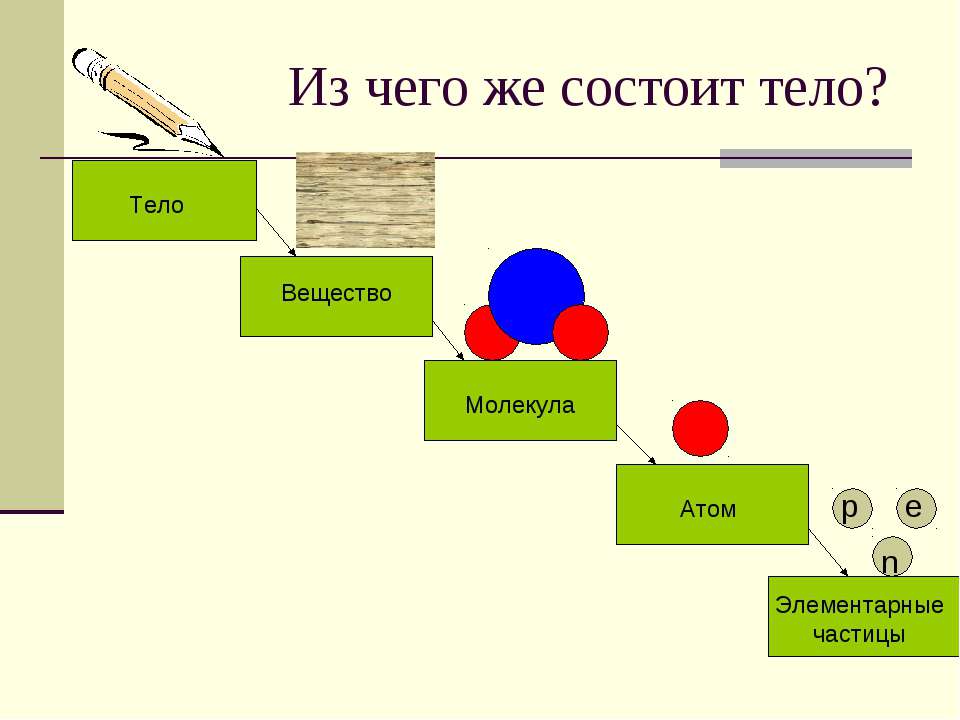
Как здание состоит из кирпичиков, а любой механизм, сделанный человеком – из деталей, так и молекула состоит из простых «кирпичиков» — атомов химических элементов. Некоторые молекулы состоят всего из одного атома – например, молекулы металлов. Но подавляющее большинство веществ, которые нас окружают, имеют гораздо более сложное молекулярное строение.
Некоторые молекулы состоят всего из одного атома – например, молекулы металлов. Но подавляющее большинство веществ, которые нас окружают, имеют гораздо более сложное молекулярное строение.
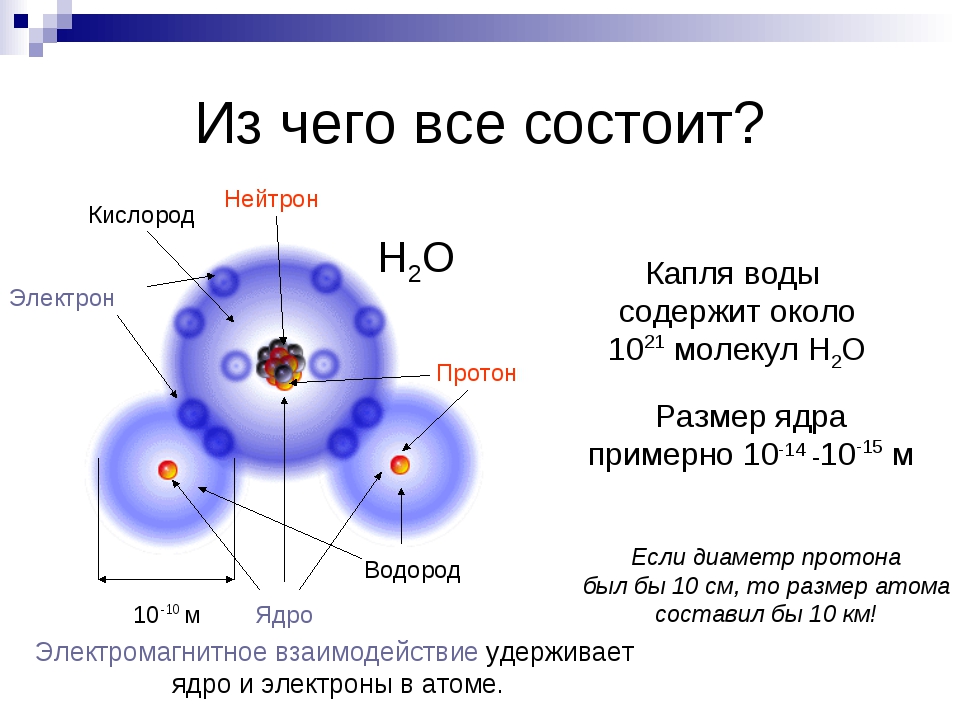
Строение любой молекулы можно записать в виде химической формулы, которая указывает, из атомов каких химических элементов состоит вещество и сколько атомов каждого вещества содержится в одной молекуле. Молекула кислорода состоит из двух одинаковых атомов элемента кислорода.
Всем известна формула воды: H2O, которая означает, что каждая молекула воды содержит один атом кислорода и два атома водорода. Еще одна известная буквально всем формула – С2Н5ОН, формула этилового спирта, которая показывает, что это вещество состоит из двух атомов углерода (С), шести атомов водорода (Н) и одного атома кислорода (О).
В процессе взаимодействия друг с другом вещества обмениваются химическими элементами, вступая в реакции. При этом образуются новые вещества, обладающие новыми свойствами, отличными от свойств исходных веществ.
Так, уголь (практически полностью состоящий из углерода), сгорая (взаимодействуя с кислородом, содержащимся в воздухе), образует углекислый газ – вещество, непригодное для дыхания, в отличие от кислорода. Молекулы в обычном состоянии не несут электрического заряда и называются нейтральными. Те молекулы, которые получают положительный или отрицательный заряд, называются ионами, а процесс – ионизацией. Молекулы, атомы которых имеют неспаренные электроны, называются радикалами.
Молекулы в обычном состоянии не несут электрического заряда и называются нейтральными. Те молекулы, которые получают положительный или отрицательный заряд, называются ионами, а процесс – ионизацией. Молекулы, атомы которых имеют неспаренные электроны, называются радикалами.
Примечания
- Молекула — статья из Большой советской энциклопедии.
- Pauling, Linus. General Chemistry (неопр.). — New York: Dover Publications, Inc., 1970. — ISBN 0-486-65622-5.
- Ebbin, Darrell, D. General Chemistry, 3rd Ed (неопр.). — Boston: Houghton Mifflin Co. (англ.)русск., 1990. — ISBN 0-395-43302-9.
- Brown, T.L. Chemistry – the Central Science, 9th Ed (неопр.). — New Jersey: Prentice Hall, 2003. — ISBN 0-13-066997-0.
- Chang, Raymond. Chemistry, 6th Ed (неопр.). — New York: McGraw-Hill Education, 1998. — ISBN 0-07-115221-0.
- Zumdahl, Steven S. Chemistry, 4th ed (неопр.). — Boston: Houghton Mifflin (англ.)русск., 1997. — ISBN 0-669-41794-7.
- Войшвалло Е. К. Понятие как форма мышления: логико-гносеологический анализ. — М.: МГУ, 1989. — С. 181. — 238 с.
- Татевский В. М. Квантовая механика и теория строения молекул. — М.: Изд-во МГУ, . — 162 с.
Представление структуры молекул
Молекулы состоят из электронов и атомных ядер, расположение последних в молекуле передаёт структурная формула (для передачи состава используется т. н. брутто-формула). Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов. Отдельно рассматриваются макромолекулы полимеров.
Молекулы являются объектом изучения теории строения молекул, квантовой химии, аппарат которых активно использует достижения квантовой физики, в том числе релятивистских её разделов. Также в настоящее время развивается такая область химии, как молекулярный дизайн. Для определения строения молекул конкретного вещества современная наука располагает колоссальным набором средств: электронная спектроскопия, колебательная спектроскопия, ядерный магнитный резонанс и электронный парамагнитный резонанс и многие другие, но единственными прямыми методами в настоящее время являются дифракционные методы, как то: рентгеноструктурный анализ и дифракция нейтронов.
Откуда взялось слово «молекула»?
Как и большинство химических терминов, слово «молекула» имеет в основе латынь. Оно образовано из двух слов: «мoles», имеющего значение массы, тяжести и «-cule» — уменьшительного суффикса. Дословное значение – маленькая масса.
В современной химии молекула – мельчайшая частица какого-либо вещества. Даже одна молекула любого вещества обладает всеми свойствами, которые характерны для этого вещества.
Если молекулу разделить на составные части, вещество, которое она составляла, уничтожится, распавшись на более простые элементы – атомы. На этой основе сформирован весь свод понятий, образующих современную химическую науку и практику.
Реакции обмена между электролитами. Ионные уравнения
Поскольку электролиты в растворах распадаются на ионы, то и реакции электролитов должны происходить между ионами. Взаимодействие ионов в растворе называется ионной реакцией. • Запишите формулировку в тетрадь. С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим обменные реакции электролитов в растворе, например взаимодействие между двумя солями: NaCl + AgNO3 =AgCl↓ + NaNO3 Хлорид натрия и нитрат серебра как сильные электролиты диссоциируют на ионы: NaCl ⇄ Na+ + Cl— AgNO3 ⇄ Ag+ + NO3— поэтому левую часть равенства можно записать в таком виде: Na+ + Cl— + Ag+ + NO3— = Рассмотрим полученные в результате реакции вещества: AgCl вещество нерастворимое, поэтому оно не будет диссоциировать на ионы, a NaNO3 — соль растворимая, прекрасно диссоциирует на ионы по схеме NaNO3 ⇄ Na+ + NO3—
NaNO3 — сильный электролит, поэтому правая часть равенства пишется так: … = Na+ + NO3— + AgCl Уравнение в целом будет иметь следующий вид: Na+ + Cl— + Ag+ + NO3— = Na+ + NO3— + AgCl Такое уравнение называется полным ионным уравнением. Сокращая в этом уравнении подобные члены, получаем сокращенное ионное уравнение Ag+ + Cl— = AgCl Итак, последовательность составления ионного уравнения. 1. Написать в ионном виде формулы исходных продуктов (тех, которые диссоциируют). 2. Написать в ионном виде формулы полученных продуктов (тех, которые диссоциируют). 3. Проверить, совпадает ли по абсолютной величине общее число положительных и отрицательных зарядов ионов в левой части равенства, а затем в правой. 4. Проверить, совпадает ли число одноименных ионов в левой и правой части равенства (учитывая атомы, входящие в состав недиссоциирующего вещества). На этом составление полного ионного уравнения заканчивается. • Запишите последовательность составления ионного уравнения в тетрадь. 5. Для составления сокращенного ионного уравнения следует найти в левой и правой частях уравнения подобные члены с одинаковыми знаками и исключить их из уравнения, а затем записать полученное сокращенное ионное уравнение. Приведенное сокращенное ионное уравнение выражает сущность не только этой реакции. Напишем несколько уравнений реакций, например: 1) НСl + AgNO3 = AgCl↓ + HNO3 Н+ + Cl— + Ag+ + NO3— = H+ + NO3— + AgCl↓
Ag+ + Cl— = AgCl
2Na+ + CO23— + 2H+ + 2NO3— = 2Na+ + 2NO3— + H2O + CO2↓
2К+ + 2Сl— + 2Na+ + SO24— ⇄ 2Na+ + 2Cl— + 2K+ + SO24— Сокращенного ионного уравнения здесь, разумеется написать нельзя
■ 83. Какие реакции называются ионными? (См. Ответ) 84. Как составляются полное ионное и сокращенное ионное уравнения? 85. Составьте молекулярные, полные ионные и сокращенные ион-ные уравнения следующих реакций: а) хлорид хрома (III) + нитрат серебра;
б) хлорид железа (III) + едкий натр; в) сульфид натрия + соляная кислота г) гидроокись кальция + азотная кислота; д) хлорид натрия 4- нитрат свинца; е) нитрат бария + сульфат натрия; ж) сульфат алюминия + едкое кали; з) хлорид бария + сульфат марганца; и) фосфат натрия + хлорид кальция. 86. Составьте ионные уравнения реакции укажите, какие из них будут обратимы и почему: а) едкий натр + хлорид калия; б) сульфат железа (III)4- хлорид бария; в) хлорид магния + нитрат натрия; г) нитрат железа (III) + едкое кали; д) хлорид цинка + едкий натр; е) сульфат натрия + хлорид меди (II) 87. Укажите, могут ли находиться в растворе одновременно ионы: а) Ва2+ и SO24—; б) Са2+ и Mg2+; в) Сu2+ и ОН—; г) Fe3+ и SO24—; д) S2- и Na+; е) PO34— и Mg2+. 88. Напишите несколько уравнений реакций нейтрализации и выведите для них общее сокращенное ионное уравнение. 89. С помощью каких веществ можно осуществить следующие реакции: а) Са2+ + СО23— → СаСО3 б) Fe2+ + 2OН— → Fe(OH)2 в) ЗСu2+ + 2PO34— → Cu3(PO4)2 (См. Ответ)
Большое значение имеют реакции ионного обмена, протекающие между электролитом и сложным, нерастворимым органическим веществом, в состав которого входит ион, способный обмениваться на другой, содержащийся в растворе электролита . Пропуская раствор электролита через такое вещество, называемое ионнообменником или ионитом, можно освободиться от нежелательных ионов, содержащихся в растворе. На этом основаны некоторые способы очистки воды, устранения ее жесткости. Для этой цели применяются как природные, так и приготовленные искусственным путем ионнообменники. Природные ионнообменники играют важную роль в почвенных процессах. Знание поведения электролитов в растворах, а также электронные представления о строении атомов и молекул позволяют по-новому рассматривать свойства оснований кислот и солей.
Статья на тему Осмос
Взаимодействие атомов при образовании молекулы
Природа химических связей в молекуле оставалась загадкой до создания квантовой механики — классическая физика не могла объяснить насыщаемость и направленность валентных связей. Основы теории химической связи были заложены в 1927 году Гайтлером и Лондоном на примере простейшей молекулы Н2. Позже теория и методы расчётов были значительно усовершенствованы.
Химические связи в молекулах подавляющего большинства органических соединений является ковалентными. Среди неорганических соединений существуют ионные и донорно-акцепторные связи, которые реализуются в результате обобществления пары электронов атома. Энергия образования молекулы из атомов во многих рядах подобных соединений приближённо аддитивна. То есть можно считать, что энергия молекулы — это сумма энергий её связей, имеющих постоянные значения в таких рядах.
Аддитивность энергии молекулы выполняется не всегда. Примером нарушения аддитивности являются плоские молекулы органических соединений с так называемыми сопряжёнными связями, то есть с кратными связями, которые чередуются с единичными. Сильная делокализация p-состояний электронов приводит к стабилизации молекулы. Выравнивание электронной плотности вследствие коллективизации p-состояний электронов по связям выражается в укорочении двойных связей и удлинении одинарных. В правильном шестиугольнике межуглеродных связей бензола все связи одинаковы и имеют длину, среднюю между длиной одинарной и двойной связи. Сопряжение связей ярко проявляется в молекулярных спектрах. Современная квантовомеханическая теория химических связей учитывает делокализации не только p-, но и s-состояний электронов, которая наблюдается в любых молекулах.
В подавляющем большинстве случаев суммарный спин валентных электронов в молекуле равен нулю. Молекулы, содержащие неспаренные электроны — свободные радикалы (например, атомарный водород Н, метил ·CH3), обычно неустойчивы, поскольку при их взаимодействии друг с другом происходит значительное снижение энергии вследствие образования ковалентных связей. Они могут устойчиво существовать при таких температурах, когда средняя кинетическая энергия молекулы превосходит или сравнима с энергией связи, но при этом ниже энергии разрушения (например ионизации) радикала.
Спектры и строение молекул
Электрические, оптические, магнитные и другие свойства молекул связаны с волновыми функциями и энергиями различных состояний молекул. Информацию о состояниях молекул и вероятности перехода между ними дают молекулярные спектры.
Частоты колебаний в спектрах определяются массами атомов, их расположением и динамикой межатомных взаимодействий. Частоты в спектрах зависят от моментов инерции молекул, определение которых из спектроскопических данных позволяет получить точные значения межатомных расстояний в молекуле. Общее число линий и полос в колебательном спектре молекулы зависит от её симметрии.
Электронные переходы в молекулах характеризуют структуру их электронных оболочек и состояние химических связей. Спектры молекул, которые имеют большее количество связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Вещества, которые построены из таких молекул, характеризуются окраской; к таким веществам относятся все органические красители.
Молекулы в науке
В химии это основное понятие, молекулярное строение определяется исходя из химических реакций с веществом. Также можно, зная строение, установить, какими будут реакции. В результате химических исследований получена основная доля знаний о молекулярной функциональности и строении.
Строением в физике объясняются физические свойства жидкостей, газов и твердых тел. Подвижность молекул определяет, как быстро вещество способно проникать в другое при соприкосновении, уровень вязкости и показатель теплопроводности.
В биологии молекулярные свойства и пространственное строение имеют первостепенное значение, так как все живое функционирует благодаря тонкому балансу взаимодействия между молекулами (химического и нехимического).
На вопрос, из чего состоят молекулы, можно ответить так – из определенного числа атомов, соединенных вместе химическими связями. Из молекул состоят все вещества на планете, физические и химические свойства которых определяются строением и составом молекул.
Молекулы в химии, физике и биологии
Понятие молекулы является основным для химии, и большей частью сведений о строении и функциональность молекул наука обязана химическим исследованиям. Химия определяет строение молекул на основе химических реакций и, наоборот, на основе строения молекулы определяет, каким будет ход реакций.
Строением и свойствами молекулы определяются физические явления, которые изучаются молекулярной физикой. В физике понятие молекулы используется для объяснения свойств газов, жидкостей и твёрдых тел. Подвижностью молекул определяется способность вещества к диффузии, его вязкость, теплопроводность и т. д. Первое прямое экспериментальное доказательство существования молекул было получено французским физиком Жаном Перреном в 1906 году при изучении броуновского движения.
Поскольку все живые организмы существуют на основе тонко сбалансированного химического и нехимического взаимодействия между молекулами, изучение строения и свойств молекул имеет фундаментальное значение для биологии и естествознания в целом.
Развитие биологии, химии и молекулярной физики привели к возникновению молекулярной биологии, которая исследует основные явления жизни, исходя из строения и свойств биологически функциональных молекул.
Чему равна масса молекулы?
Конечно, таких чувствительных весов, которые позволяли бы взвесить одну молекулу вещества, не существует в арсенале современной науки. Масса молекул и атомов вычисляется другими способами. Принято считать, что масса молекулы любого вещества равна сумме масс всех атомов, из которых состоит это вещество.
Но как узнать, сколько весит атом? Это можно узнать из Периодической таблицы элементов Менделеева, где указана масса каждого элемента. Правда, указана не в привычных нам килограммах, а в специальных единицах атомной массы.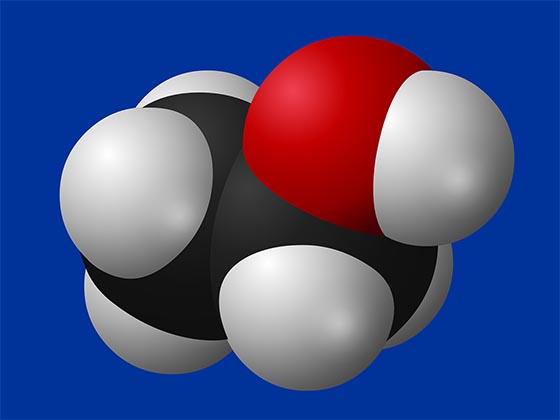 Одна атомная единица массы (а.е.м.) равна 1/12 массы атома углерода, что в численном выражении равно 1,660*10-27 кг.
Одна атомная единица массы (а.е.м.) равна 1/12 массы атома углерода, что в численном выражении равно 1,660*10-27 кг.
Т.е. чтобы подсчитать, сколько весит молекула вещества, нужно взять его формулу, сложить атомные массы всех входящих в нее элементов и умножить на вес атомной единицы массы.
Строение молекул
У молекулы какого-либо соединения состав неизменный, в ней всегда одинаковое число атомов, химические свойства зависят от валентных связей, их скрепляющих. Классическая теория рассматривает молекулу как динамическую структуру, состоящую из ядер атомов и их групп и некоторого числа электронов, находящихся на внутренних и внешних уровнях.
Строение молекулы воды
Химические связи образуют обычно только внешние электроны. Связь создается 1,2 или 3 парами электронов 2 соседних атомов (в результате чего появляется электронное облако). Энергия взаимодействия атомов зависит от дистанции, на которой они находятся, и способствует стабильности молекулы при обычных условиях: она не дает атомам чересчур сближаться.
Атомы могут быть заряжены положительно и отрицательно, их число всегда постоянно. На строение и состав молекул определенного вещества не влияет то, как оно было получено, то есть искусственно произведенное вещество будет точно таким же, как и натуральное.
Молекулярный состав записывается с помощью химических формул. Строение определяет, какими физическими свойствами будет обладать вещество.
Интересный факт: органические вещества, вода, углекислый газ плавятся и кипят при относительно низких температурах, сохраняют свою структуру и в твердом состоянии. Многие неорганические вещества состоят не из молекул, а атомов (кристаллы, чистые металлы и др.).
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH2+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Что такое молекула?
Название «молекула» происходит от латинского molecula – это уменьшительное от слова moles (в переводе масса). Впервые их существование было доказано в эксперименте в 1906 г. Ж. Перреном, французским физиком, когда он изучал броуновское движение.
 Жан Батист Перрен с «мега-спектроскопом» в Институте Кюри. 1927 г.
Жан Батист Перрен с «мега-спектроскопом» в Институте Кюри. 1927 г.
В химии так называется отдельная частица вещества, которая состоит из 2 или больше атомов, связанных между собой ковалентными связями. Квантовая механика определяет ее как систему, состоящую не из атомов, а из их ядер и электронов, с ними взаимодействующих.
Интересный факт: физика называет молекулами не только многоатомные частицы, но и одноатомные, состоящие из атомов, не соединенных между собой химическими связями (чистая ртуть или инертные газы). В этом случае понятия «молекула» и «атом» совмещаются.
Обыкновенно молекулы электрически нейтральны, так как число протонов и электронов в них одинаково, но бывают молекулы, имеющие электрический заряд (называются они ионы).
Частицы вещества с большой молекулярной массой получили название макромолекулы. Из них состоят протеины, нуклеиновые кислоты, ферменты, полисахариды, аминокислоты, сложные липиды и отдельные созданные искусственно соединения, например, полимеры. Они включают в себя сотни и тысячи атомов. Производные углеводородов – органические вещества и биополимеры, как правило, не только имеют большую массу, но и устроены сложнее, чем неорганические соединения.