Одно- и трехэлектронные связи
Диаграммы Льюиса и МО отдельной связи 2e и связи 3e
Связи с одним или тремя электронами могут быть найдены в радикалах , которые имеют нечетное количество электронов. Простейшим примером 1-электронной связи находится в дигидрофосфата катиона , H+ 2. Одноэлектронные связи часто имеют примерно половину энергии связи, чем двухэлектронные связи, и поэтому называются «полусвязями». Однако есть исключения: в случае дилития связь на самом деле сильнее для одноэлектронного Li+ 2чем для 2-электронного Li 2 . Это исключение можно объяснить с точки зрения гибридизации и эффектов внутренней оболочки.
Простейший пример трехэлектронной связи можно найти в димерном катионе гелия He+ 2. Она считается «полусвязью», потому что состоит только из одного общего электрона (а не из двух); в терминах молекулярных орбиталей третий электрон находится на антисвязывающей орбитали, которая нейтрализует половину связи, образованной двумя другими электронами. Другим примером молекулы, содержащей 3-хэлектронную связь, помимо двух 2-электронных связей, является оксид азота , NO. Молекулу кислорода, O 2 , также можно рассматривать как имеющие два 3-электронные связи и один 2-электрон связь, на долю которого приходится его парамагнетизмом и его формальных порядка облигаций 2. диоксида хлора и его более тяжелых аналоги двуокиси брома и йода диоксида также содержать трехэлектронные связи.
Молекулы со связями нечетных электронов обычно обладают высокой реакционной способностью. Эти типы связи стабильны только между атомами с аналогичной электроотрицательностью.
Модифицированные структуры Льюиса со связями 3e
Оксид азота
Дикислород
Металлическая химическая связь
 Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Строение вещества металла таково: кристаллическая решётка является остовом вещества, а между её узлами электроны могут свободно перемещаться.
Можно привести следующие примеры:
Mg — 2е <,—>, Mg2+
Cs — e <,—>, Cs+
Ca — 2e <,—>, Ca2+
Fe — 3e <,—>, Fe3+
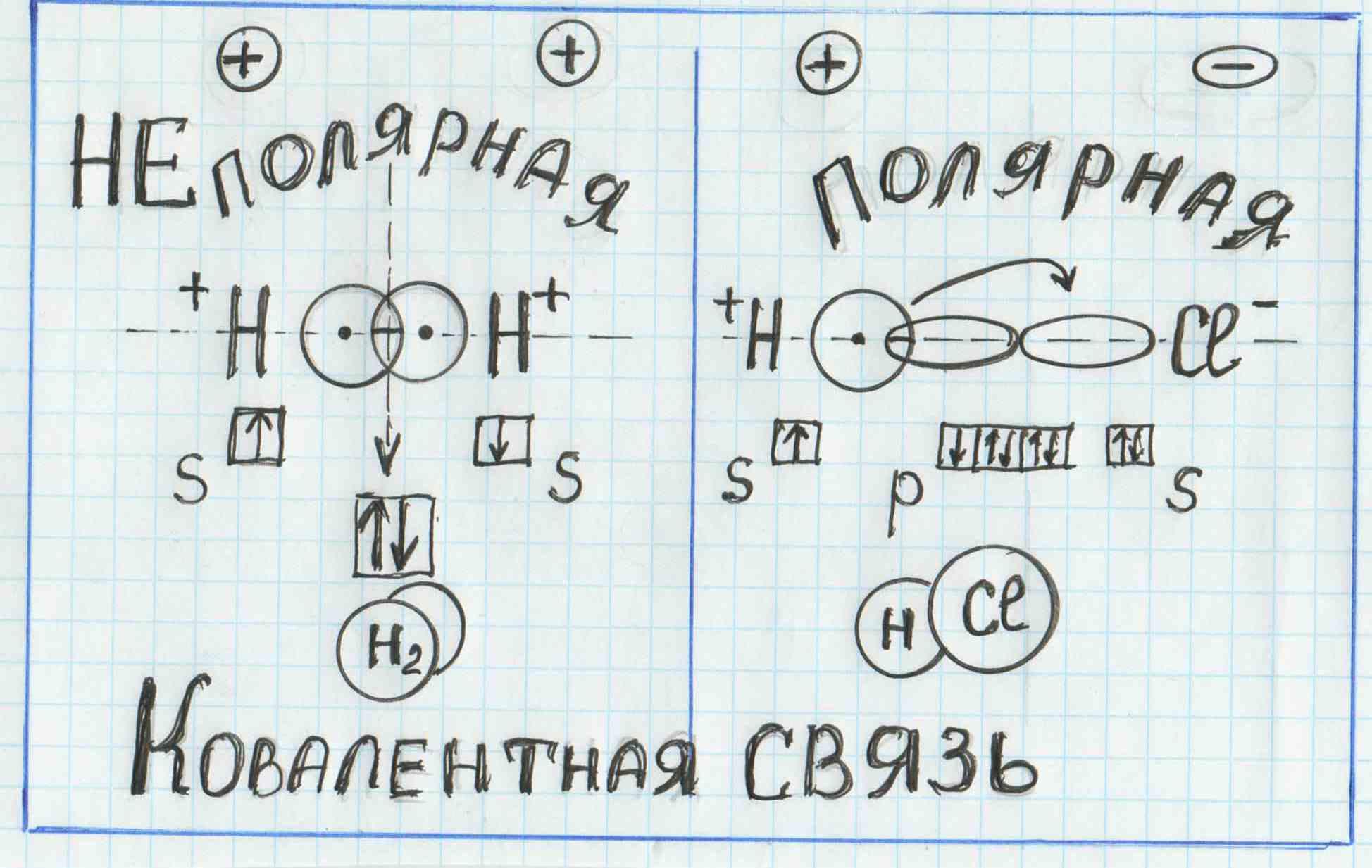
Характерные свойства ковалентной связи
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы.
Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
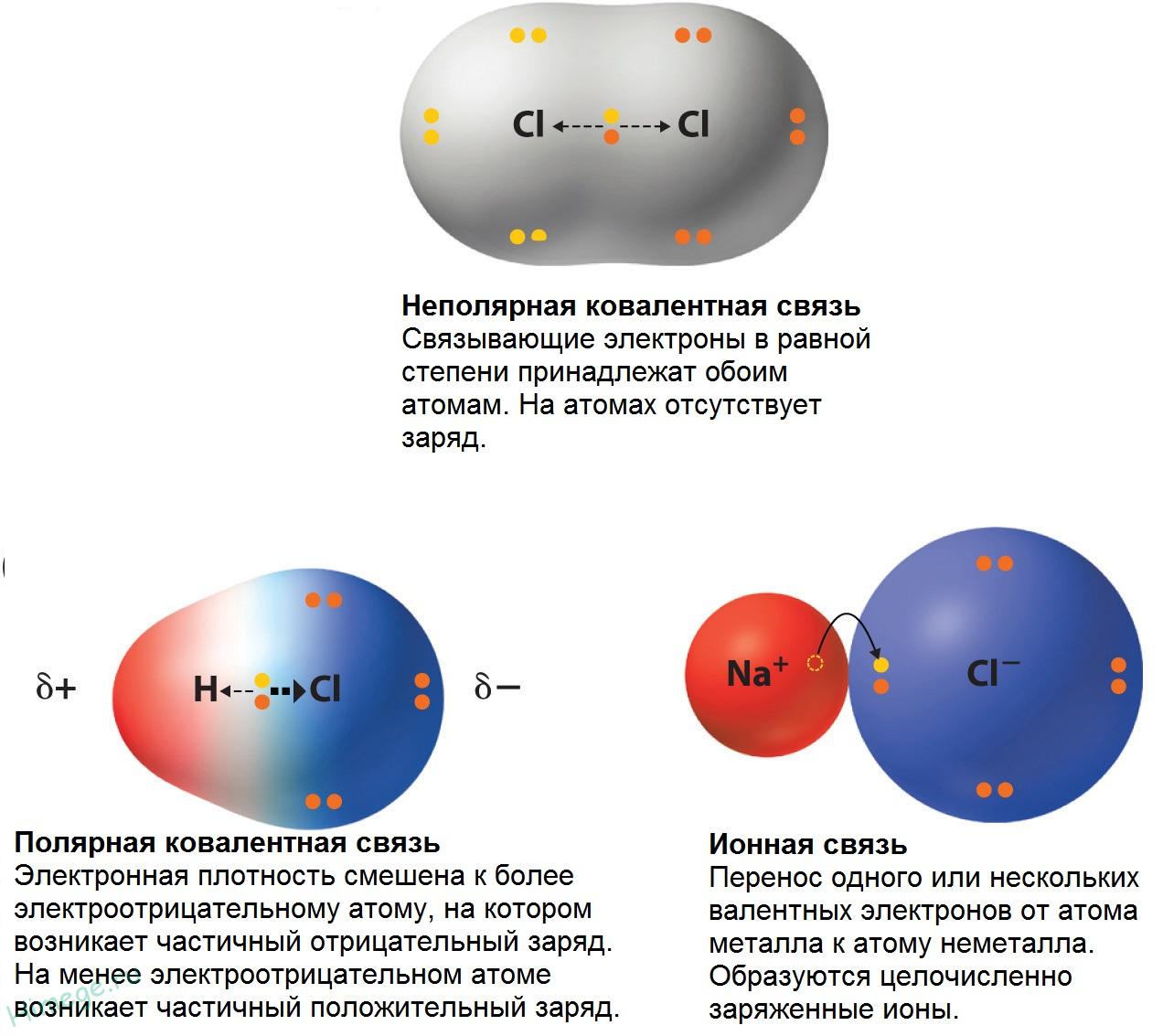
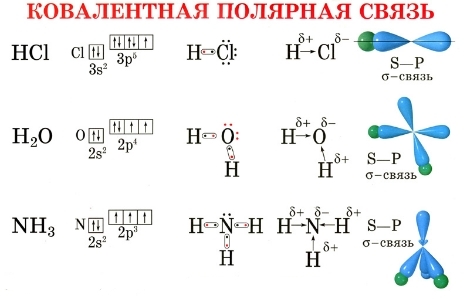
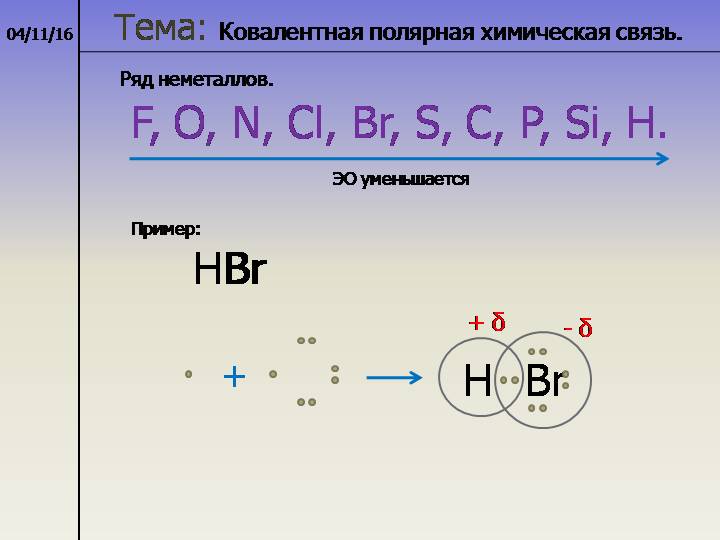
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов.
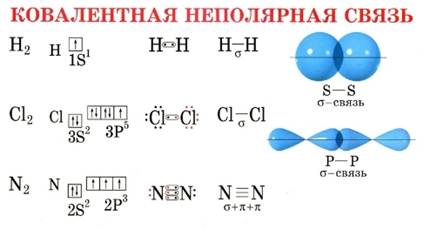
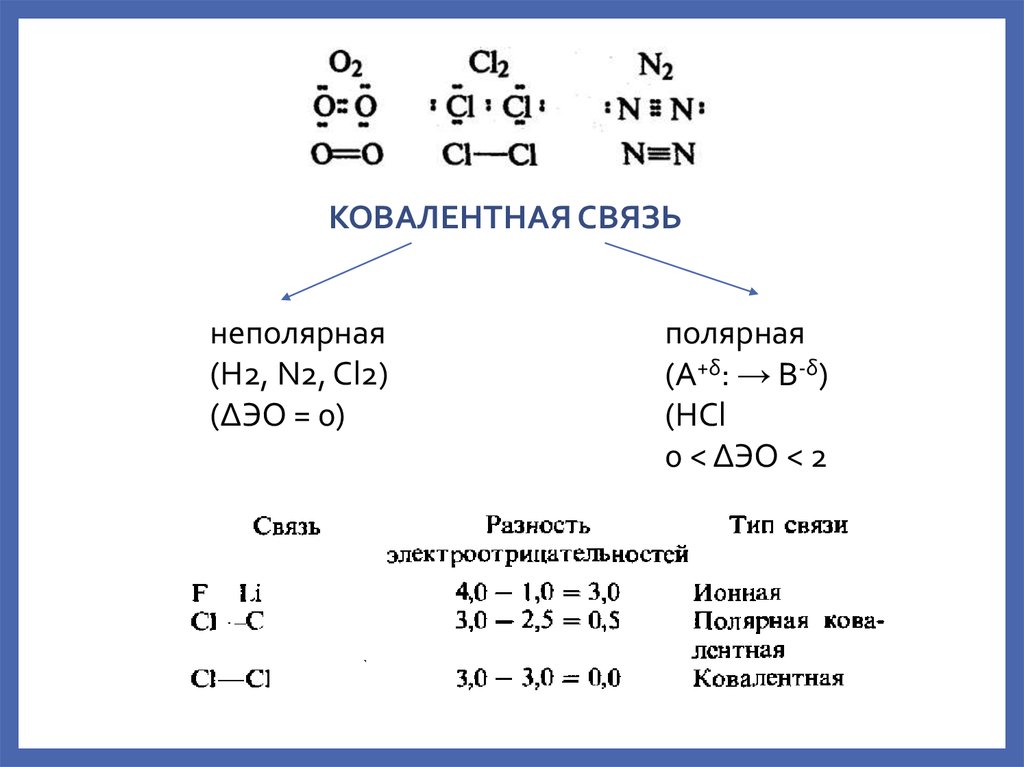
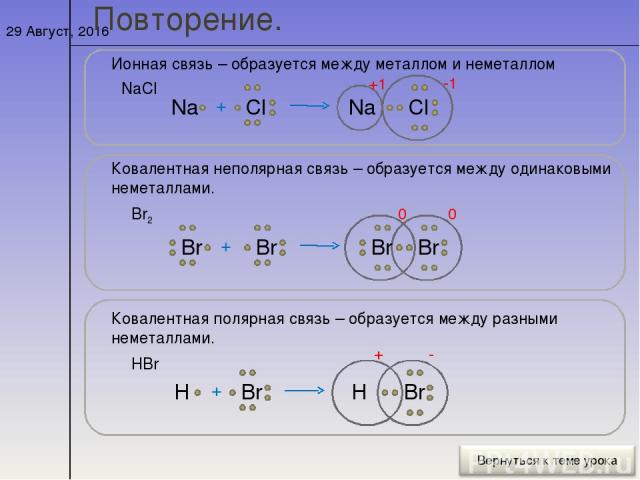
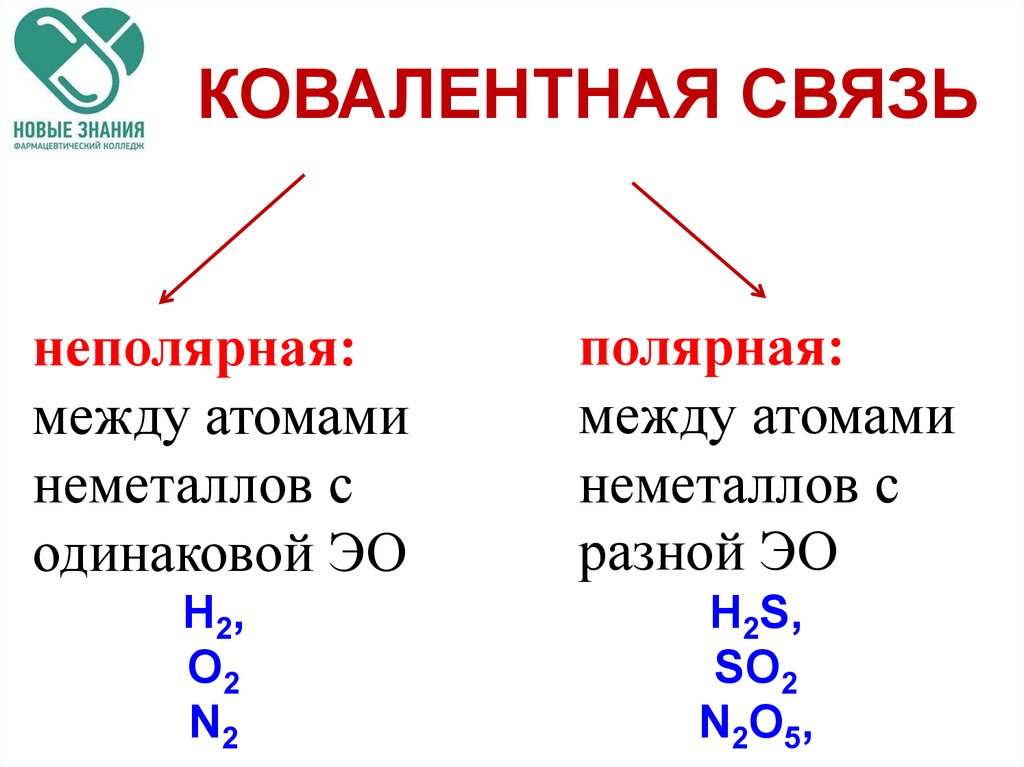
По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Однако, дважды лауреат Нобелевской премии Л. Полинг указывал, что «в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары». Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H2+.
Молекулярный ион водорода H2+ содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H2+). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α=0,53 А и является центром симметрии молекулярного иона водорода H2+.
Механизм образования ковалентной связи
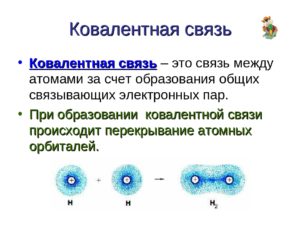
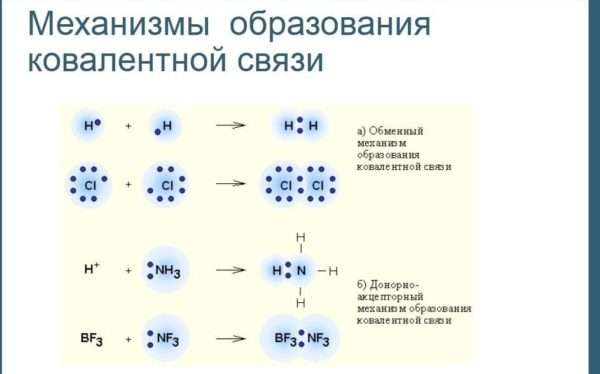
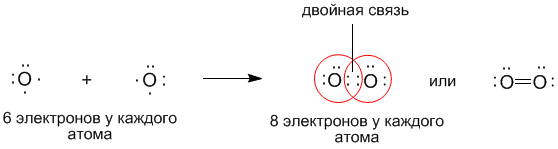
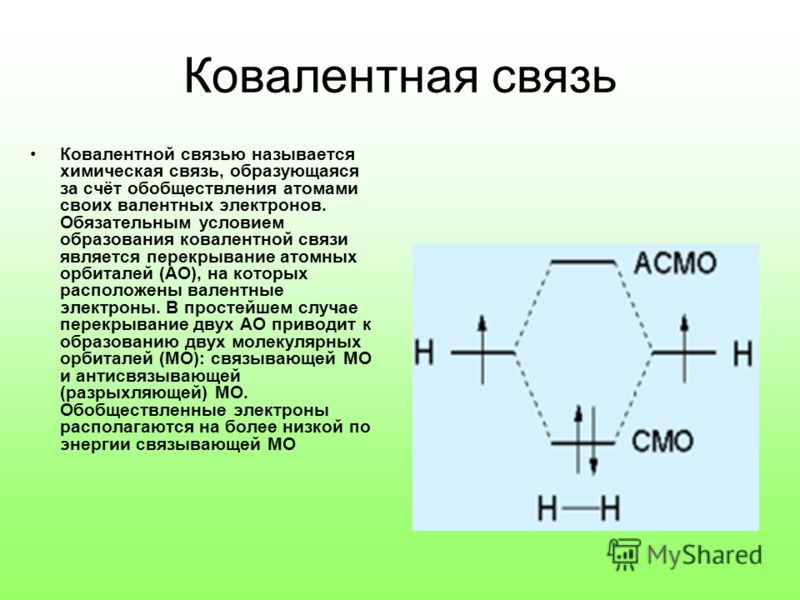
Основным признаком ковалентной связи является наличие общей электронной пары, принадлежащей обоим химически соединенным атомам, поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра. Возникновение общей электронной пары связи может проходить по разным механизмам, чаще — по обменному, а иногда — по донорно-акцепторных.
по принципу обменного механизма образования ковалентной связи каждый из взаимодействующих атомов поставляет на образование связи одинаковое количество электронов с антипараллельными спинами. К примеру:
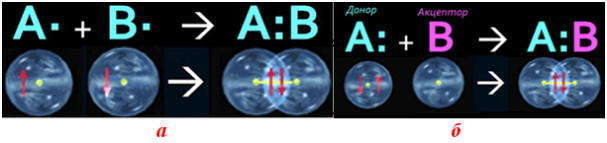
Общая схема образования ковалентной связи: а) по обменному механизму; б) по донорно-акцепторному механизму
по донорно-акцепторному механизму двухэлектронная связь возникает при взаимодействии различных частиц. Одна из них — донор А: имеет неразделенную пару электронов (то есть такую, что принадлежит только одному атому), а другая — акцептор В — имеет вакантную орбиталь.
Донорно-акцепторный связь иначе называется семиполярной, поскольку на атоме-доноре возникает частичный эффективный положительный заряд δ+ (за счет того, что его неразделенная пара электронов отклонилась от него), а на атоме-акцепторе — частичный эффективный отрицательный заряд δ- (благодаря тому, что происходит смещение в его сторону неразделенной электронной пары донора).
В качестве примера простого донора электронной пары можно привести ион водорода Н—, который имеет неразделенную электронную пару. В результате присоединения негативного гидрид-иона к молекуле, центральный атом которой имеет свободную орбиталь (на схеме обозначена как пустая квантовая ячейка), например ВН3 , образуется сложный комплексный ион ВН4— с отрицательным зарядом (Н— + ВН3 ⟶⟶ [ВН4]—) :
Акцептор электронной пары — ион водорода, или просто протон Н+. Его присоединение к молекуле, центральный атом которой имеет неразделенную электронную пару, например к NH3 , тоже приводит к образованию комплексного иона NH4+ , но уже с положительным зарядом:

А: + B= А:В

При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH2+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
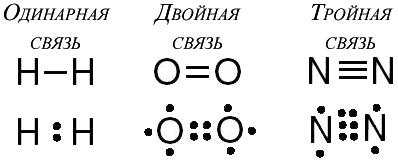
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.

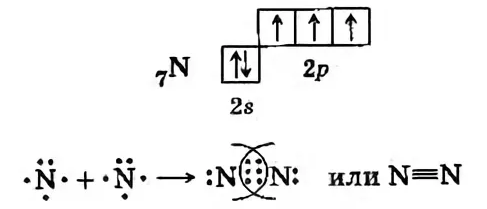
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.

Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Образование связи
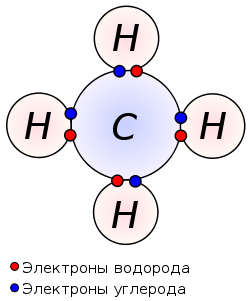
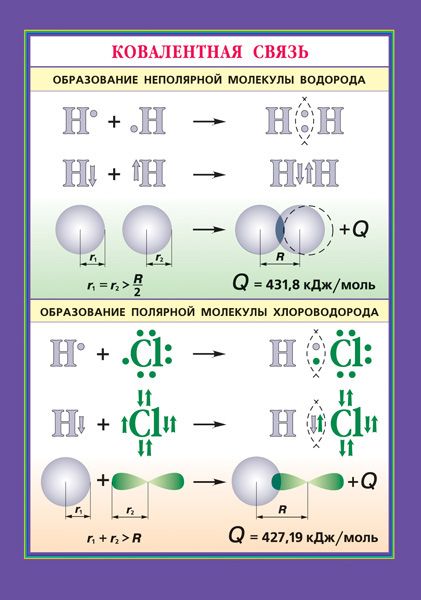
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома.
- A· + ·В → А: В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет ни чем иным, как энергией связи).
Заполнение электронами атомных (по краям) и молекулярных (в центре) орбиталей в молекуле H2. Вертикальная ось соответствует энергетическому уровню, электроны обозначены стрелками, отражающими их спины.
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществлённые электроны располагаются на более низкой по энергии связывающей МО.
Образование связи при рекомбинации атомов
Атомы и свободные радикалы склонны к рекомбинации — образованию ковалентной связи путём обобществления двух неспаренных электронов, принадлежащих разным частицам.
H + H → H2;
·CH3 + ·CH3 → CH3 — CH3.
Образование связи при рекомбинации сопровождается выделением энергии. Так, при взаимодействии атомов водорода выделяется энергия в количестве 436 кДж/моль. Этот эффект используют в технике при атомно-водородной сварке. Поток водорода пропускают через электрическую дугу, где генерируется поток атомов водорода. Атомы затем вновь соединяются на металлической поверхности, помещаемой на небольшое расстояние от дуги. Металл может быть таким путём нагрет выше 3500°C. Большим достоинством «пламени атомного водорода» является равномерность нагрева, позволяющая сваривать очень тонкие металлические детали.
Однако, механизм межатомного взаимодействия долгое время оставался неизвестным. Лишь в 1930 г. Ф. Лондон ввёл понятие дисперсионное притяжение — взаимодействие между мгновенным и наведённым (индуцированными) диполями. В настоящее время силы притяжения, обусловленные взаимодействием между флуктуирующими электрическими диполями атомов и молекул носят название «Лондоновские силы».
Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости α и обратно пропорциональна расстоянию между двумя атомами или молекулами в шестой степени.
Образование связи по донорно-акцепторному механизму
Кроме изложенного в предыдущем разделе гомогенного механизма образования ковалентной связи, существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H+ и отрицательного иона водорода H-, называемого гидрид-ионом:
H+ + H- → H2
При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Распределение электронной плотности между ядрами в молекуле водорода одно и то же, независимо от механизма образования, поэтому называть химическую связь, полученную по донорно-акцепторному механизму, донорно-акцепторной связью некорректно.
В качестве донора электронной пары, кроме гидрид-иона, выступают соединения элементов главных подгрупп V—VII групп периодической системы элементов в низшей степени окисления элемента. Так, ещё Йоханнес Брёнстед установил, что протон не существует в растворе в свободном виде, в воде он образует катион оксония:
H+ + H2O → H3O+
Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион, существующий в водных растворах кислот.
Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катиона аммония:
NH3 + H+ → NH4+
Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большой класс ониевых соединений, в состав которого входят аммониевые, оксониевые, фосфониевые, сульфониевые и другие соединения.
В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протоном приводит к образованию молекулярного иона водорода H3+:
H2 + H+ → H3+
Связывающая электронная пара молекулярного иона водорода H3+ принадлежит одновременно трём протонам.
Метод валентных связей
Первая квантово-механическая теория ковалентной связи была создана Гейтлером и Лондоном (в 1927 г.) для описания молекулы водорода, а затем была применена Полингом к многоатомным молекулам. Эта теория называется методом валентных связей, основные положения которого кратко можно изложить так:
- каждая пара атомов в молекуле содержится вместе с помощью одной или нескольких общих электронных пар, при этом электронные орбитали взаимодействующих атомов перекрываются;
- прочность связи зависит от степени перекрывания электронных орбиталей;
- условием образования ковалентной связи является антинаправленность спинов электронов; благодаря этому возникает обобщенная электронная орбиталь с наибольшей электронной плотностью в межъядерном пространстве, которая обеспечивает притяжение положительно заряженных ядер друг к другу и сопровождается уменьшением общей энергии системы.
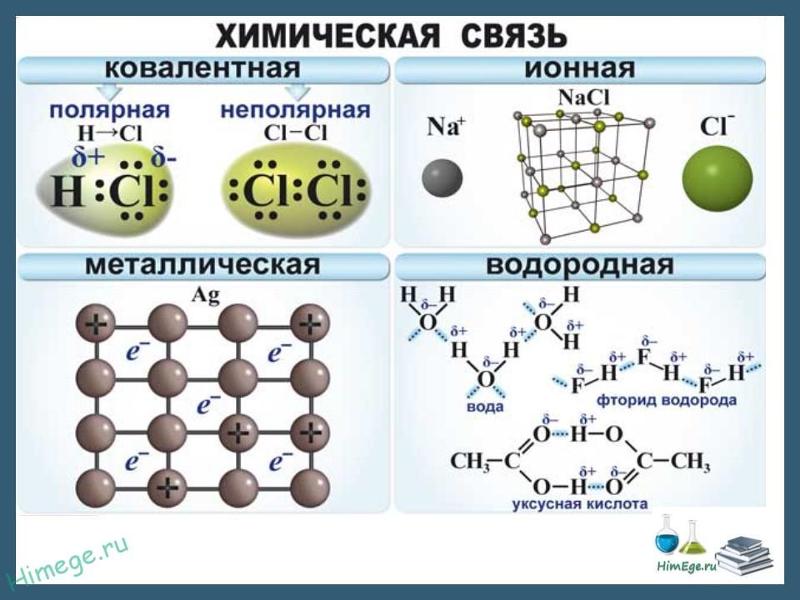
Виды химической связи. Ковалентная связь — полярная, неполярная. Характеристики, механизмы образования и виды ковалентной связи. Ионная связь. Степень окисления. Металлическая связь. Водородная связь.
|
Периодическое изменение свойств химических элементов и их соединений при увеличении заряда ядра атома объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов. |
|
|
При образовании общих электронных пар происходит перекрывание электронных орбиталей. |
|
|
σ — связь образуется при перекрывании электронных орбиталей, идущих по линии, соединяющей центры атомов |
|
|
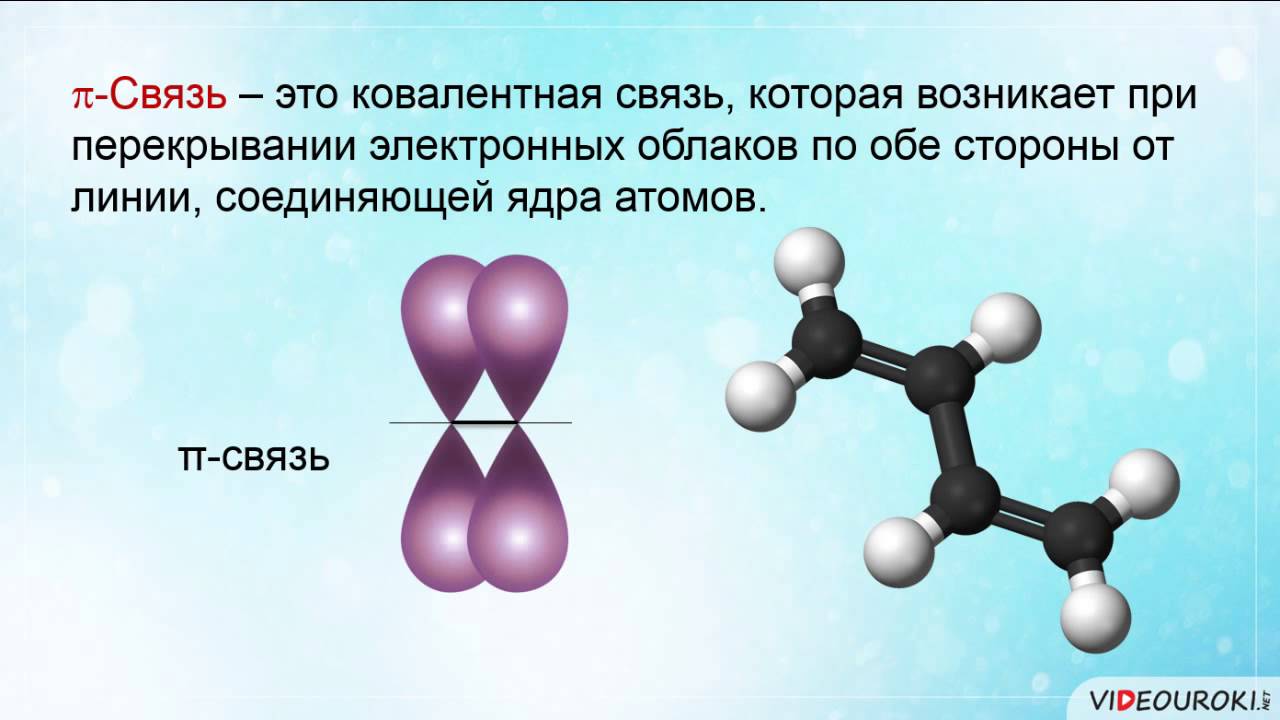
π- связь образуется при перекрывании электронных орбиталей, вне линии, соединяющей центры атомов |
|
|
Ковалентная неполярная связь — это связь между атомами с одинаковой электроотрицательностью |
|
|
Ковалентная полярная связь — это связь между атомами, электроотрицательность которых отличается незначительно |
|
|
|
|
Обменный механизм образования ковалентной связи: это когда при образовании общей электронной пары каждый из атомов предоставляет в совместное пользование по одному электрону |
|
|
Донорно-акцепторный механизм образования ковалентной связи: это когда при образовании общей электронной один из атомов (донор) дает в общее пользование электронную пару, а другой (акцептор) предоставляет свободную орбиталь |
|
|
|
|
|
|
|
|
|
|
Водородная связь: это форма ассоциации между электроотрицательным атомом и атомом водорода, связанным ковалентно с другим электроотрицательным атомом. Может быть внутримолекулярная водородная связь и межмолекулярная водородная связь. |
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.

Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Ионная связь
Самым простым предположением о природе химической связи атомов в молекуле является гипотеза о том, что между вешними электронами появляются силы взаимодействия электрической природы. При этом обязательным условием устойчивости молекулы в таком случае будет существование у двух атомов, которые взаимодействуют, электрических зарядов противоположного знака. Данный тип химической связи реализуется только в части молекул. При этом атомы, вступающие во взаимодействие, превращаются в ионы. Один из атомов присоединяет к себе один или несколько электронов и становится отрицательным ионом, при этом другой атом, отдавший электроны становится положительным ионом.
Ионная связь аналогична силам притяжения между зарядами противоположных знаков. Так, например, положительно заряженный ион натрия (${Na}^+$) притягивается к отрицательно заряженному иону хлора (${Cl}^-$), при этом образуется молекула NaCl.
Ионную связь называют еще гетерополярной (гетеро — разный). Молекулы, в которых реализуется ионный тип связи, называют ионными или гетерополярными молекулами.
При помощи одной ионной связи не удается объяснить структуры всех молекул. Так, невозможно понять, почему образуют молекулу два нейтральных атома водорода. Из-за одинаковости атомов водорода нельзя считать, что один ион водорода несет положительный заряд, а другой отрицательный. Связь, подобная связи в молекуле водорода (между нейтральными атомами) объяснима только в рамках квантовой механики. Она называется ковалентной связью.
Расчет возможного числа ковалентных связей
Для примера, подсчитаем количество ковалентных связей, которые могут образовать натрий (Na),
алюминий (Al),
фосфор (P),
и хлор (Cl)
.
Натрий (Na)
и алюминий (Al)
имеют, соответственно 1 и 3 электрона на внешней оболочке, и, по первому правилу (для механизма образования ковалентной связи используется один электрон на внешней оболочке), они могут образовать:натрий (Na)
— 1 и алюминий (Al)
— 3 ковалентных связи. После образования связей количество электронов на внешних оболочках натрия (Na)
и алюминия (Al)
равно, соответственно, 2 и 6; т.е., менее максимального количества (8) для этих атомов. Фосфор (P)
и хлор (Cl)
имеют, соответственно, 5 и 7 электронов на внешней оболочке и, согласно второй из вышеназванных закономерностей, они могли бы образовать 5 и 7 ковалентных связей. В соответствии с четвертой закономерностью образование ковалентной связи, число электронов на внешней оболочке этих атомов увеличивается на 1. Согласно шестой закономерности, когда образуется ковалентная связь, число электронов на внешней оболочке связываемых атомов не может быть более 8. То есть, фосфор (P)
может образовать только 3 связи (8-5 = 3), в то время как хлор (Cl)
может образовать только одну (8-7 = 1).
Пример:
на основании анализа мы обнаружили, что некое вещество состоит из атомов натрия (Na)
и хлора (Cl)
. Зная закономерности механизма образования ковалентных связей, мы можем сказать, что натрий (Na
) может образовать только 1 ковалентную связь. Таким образом, мы можем предположить, что каждый атом натрия (Na)
связан с атомом хлора (Cl)
посредством ковалентной связи в этом веществе, и что это вещество состоит из молекул атома NaCl
. Формула строения для этой молекулы: Na — Cl.
Здесь тире (-) означает ковалентную связь. Электронную формулу этой молекулы можно показать следующим образом: . . Na: Cl: . . В соответствии с электронной формулой, на внешней оболочке атома натрия (Na)
в NaCl
имеется 2 электрона, а на внешней оболочке атома хлора (Cl)
находится 8 электронов. В данной формуле электроны (точки) между атомами натрия (Na)
ихлора (Cl)
являются связующими электронами. Поскольку ПЭИ у хлора (Cl)
равен 13 эВ, а у натрия (Na)
он равен 5,14 эВ, связующая пара электронов находится гораздо ближе к атому Cl
, чем к атому Na
. Если энергии ионизации атомов, образующих молекулу сильно различаются, то образовавшаяся связь будет полярной
ковалентной связью.
Рассмотрим другой случай. На основании анализа мы обнаружили, что некое вещество состоит из атомов алюминия (Al)
и атомов хлора (Cl)
. У алюминия (Al)
имеется 3 электрона на внешней оболочке; таким образом, он может образовать 3 ковалентные химические связи, в то времяхлор (Cl)
, как и в предыдущем случае, может образовать только 1 связь. Это вещество представлено как AlCl 3
, а его электронную формулу можно проиллюстрировать следующим образом:
Рисунок 3.1. Электронная формула
AlCl
3
чья формула строения: Cl — Al — Cl Cl
Эта электронная формула показывает, что у AlCl 3
на внешней оболочке атомов хлора (Cl
) имеется 8 электронов, в то время, как на внешней оболочке атома алюминия (Al)
их 6. По механизму образования ковалентной связи, оба связующих электрона (по одному от каждого атома) поступают на внешние оболочки связываемых атомов.
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.

Межмолекулярные взаимо-действия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляеются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодейстий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
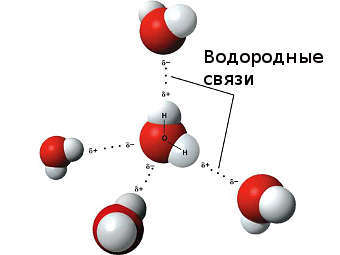
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
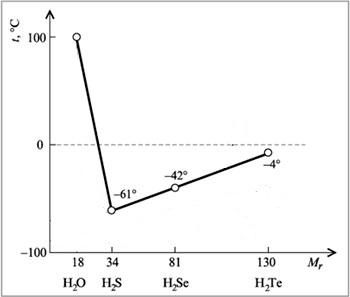
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.