Кислородосодержащие кислоты и соответствующие кислотные оксиды
Физические свойства кислот
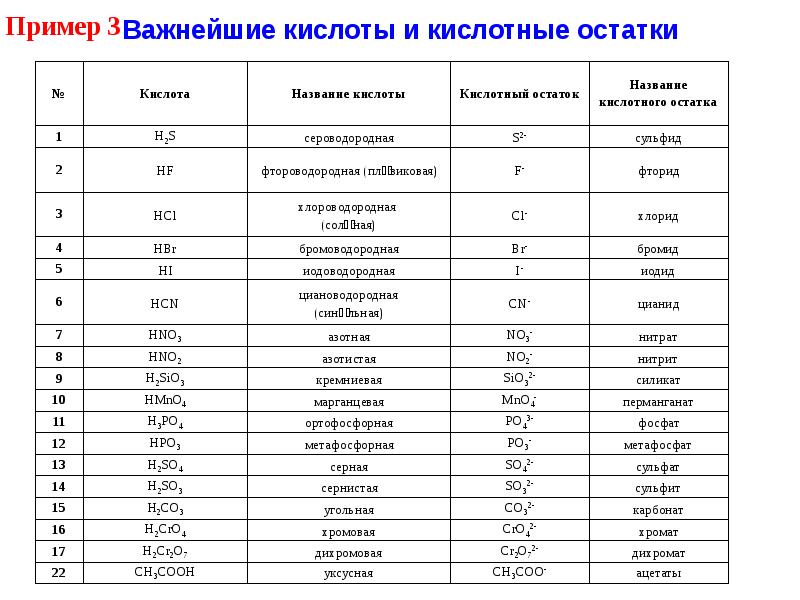
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
Получение кислот
1) Взаимодействие простых веществ
(получают бескислородные кислоты)
H2 + Cl2 = 2HCl,
H2 + S = H2S.
2) Взаимодействие кислотных оксидов с водой(получают кислородсодержащие кислоты) SO3 + H2O = H2SO4,
3) Взаимодействие солей с растворами сильных кислот
(получают слабые кислоты)
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl,
SiO32- + 2H+ = H2SiO3.
4) Электролиз водных растворов солей
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4.
Химические свойства кислот
 1) Растворы кислот кислые на вкус, изменяют окраску индикаторов:
1) Растворы кислот кислые на вкус, изменяют окраску индикаторов:
лакмуса в красный цвет, метилового оранжевого – в розовый, цвет фенолфталеина не изменяется.
В водном растворе растворимые кислоты диссоциируют, образуя ион водорода, и кислотный остаток:
HCl = H+ + Cl—.
Многоосновные кислоты диссоциируют ступенчато:
H2SO4 = H+ + HSO4—,
HSO4— = H+ + SO42-.
Суммарное уравнение:
H2SO4 = 2H+ + SO42-
2) Взаимодействие с металлами
Ca + 2HCl = CaCl2 + H2
Водород из кислот-неокислителей могут вытеснять только металлы, стоящие в электрохимическом ряду напряжений металлов до водорода.
Кислоты-окислители — азотная и серная конц., реагируют с металлами по-другому, потому что в качестве окислителя выступает элемент кислотного остатка, а не водород!
3) Взаимодействие с основными оксидами
CaO + 2HCl = CaCl2 + H2O
(если образуется растворимая соль)
4) Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + 2KOH = K2SO4 + 2H2O,
2H+ + 2OH— = 2H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O,
Cu(OH)2 + 2H+ = Cu2+ + 2H2O.
Многоосновные кислоты образуют кислые и средние соли:
H2SO4 + NaOH = NaHSO4 + H2O,
H2SO4 + 2NaOH = Na2SO4 + 2H2O.
5) Взаимодействие с солями
Реакции с солями происходят только в том случае, если в результате химического превращения образуется малодиссоциирующее вещество, выделяется газ или выпадает осадок.
CO32- + 2H+ = CO2 + H2O.
В этом случае выделяется углекислый газ и образуется малодиссоциирующее вещество – вода.
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4,
SiO32- + 2H+ = H2SiO3.
Реакция происходит, так как образуется осадок.
6) Специфические свойства кислот
Связаны с окислительно-восстановительными реакциями, бескислородные кислоты в растворе могут только окисляться (проявлять восстановительные свойства):
2KMn+7O4 + 16HCl— = Cl2 + 2KCl + 2Mn+2Cl2 + 8H2O,
H2S-2 + Br2 = S + 2HBr—.
Кислородсодержащие кислоты могут окисляться (проявлять восстановительные свойства), только когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте:
H2S+4O3 + Cl2 + H2O = H2S+6O4 + 2HCl—.
Если центральный атом находится в максимальной степени окисления, то кислоты проявляют окислительные свойства, например, взаимодействие с металлами и неметаллами:
C + 2H2S+6O4 = C+4O2 + 2S+4O2 + 2H2O,
3P + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O.
Применение кислот
В настоящее время, минеральные и органические кислоты находят множество сфер применения.
Серная кислота (H2SO4), находит широкое применение в химической технологии, для производства лакокрасочных материалов, производстве минеральных удобрений, в пищевой промышленности (пищевая добавка Е513), в качестве электролита в производстве аккумуляторных батарей.
Раствор двухромовокислого калия в серной кислоте (хромовая смесь) используются в лабораториях для мытья химической посуды. Являясь сильным окислителем, хромка позволяет отмывать посуду от следов загрязнений органическими веществами. Так же, хромовая смесь используется в органическом синтезе.

Борная кислота (H3BO3) используется в медицине как антисептик, в качестве флюса при пайке металлов, как борсодержащее удобрение, в домашнем хозяйстве используется как средство от тараканов.
Широко известны в домашнем использовании при выпечке уксусная и лимонная кислоты. Также в быту их используют для удаления накипи.
Знакомая всем с детства аскорбиновая кислота, более известная в народе как витамин С, применяется при лечении простудных заболеваний.
Азотная кислота (HNO3) находит применение при производстве взрывчатых веществ, при производстве минеральных азотсодержащих удобрений (аммиачная, калиевая селитра), в производстве лекарственных средств (нитроглицерин).