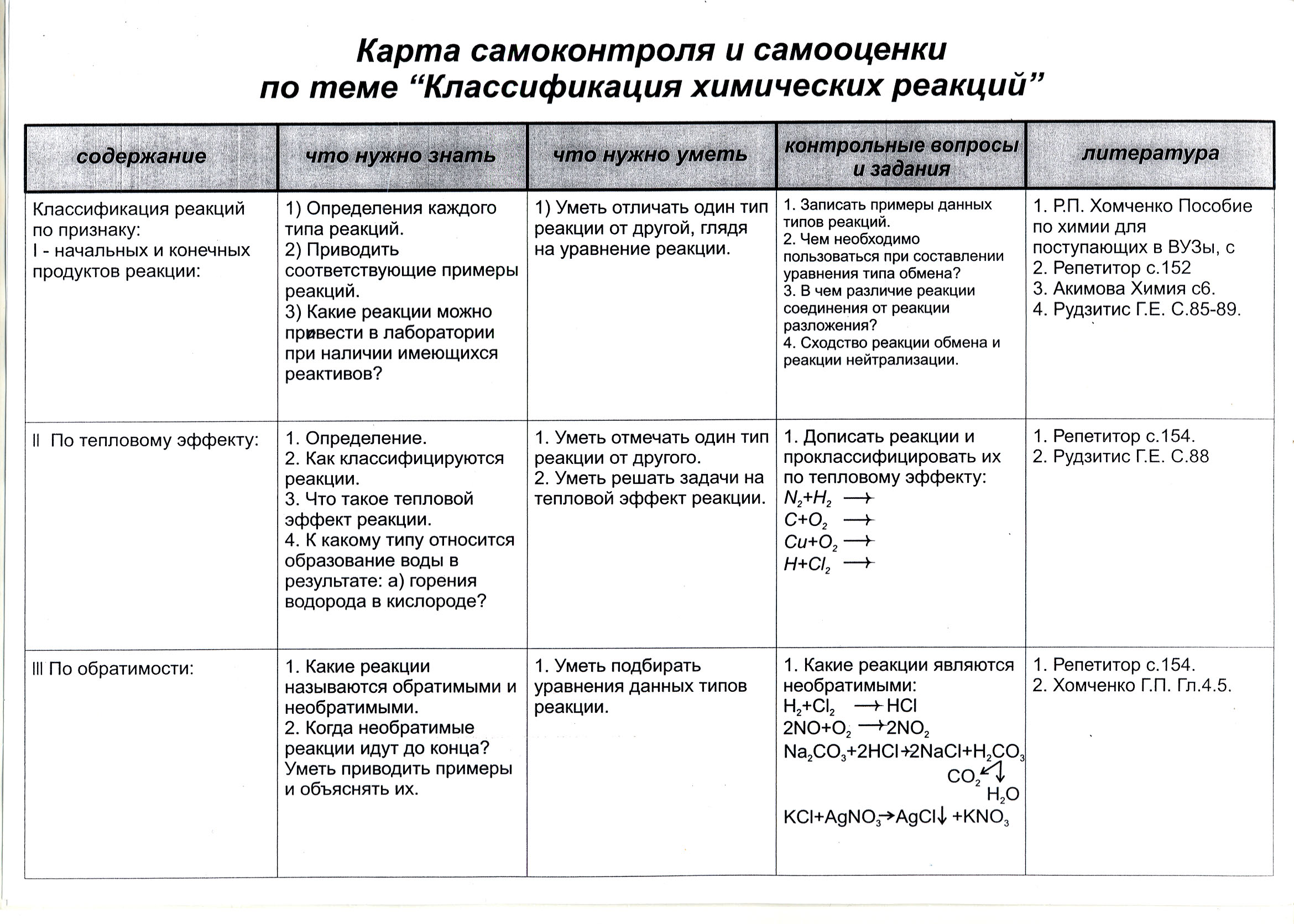
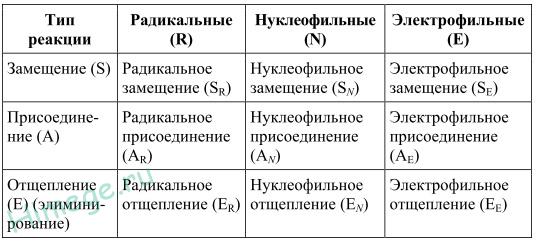
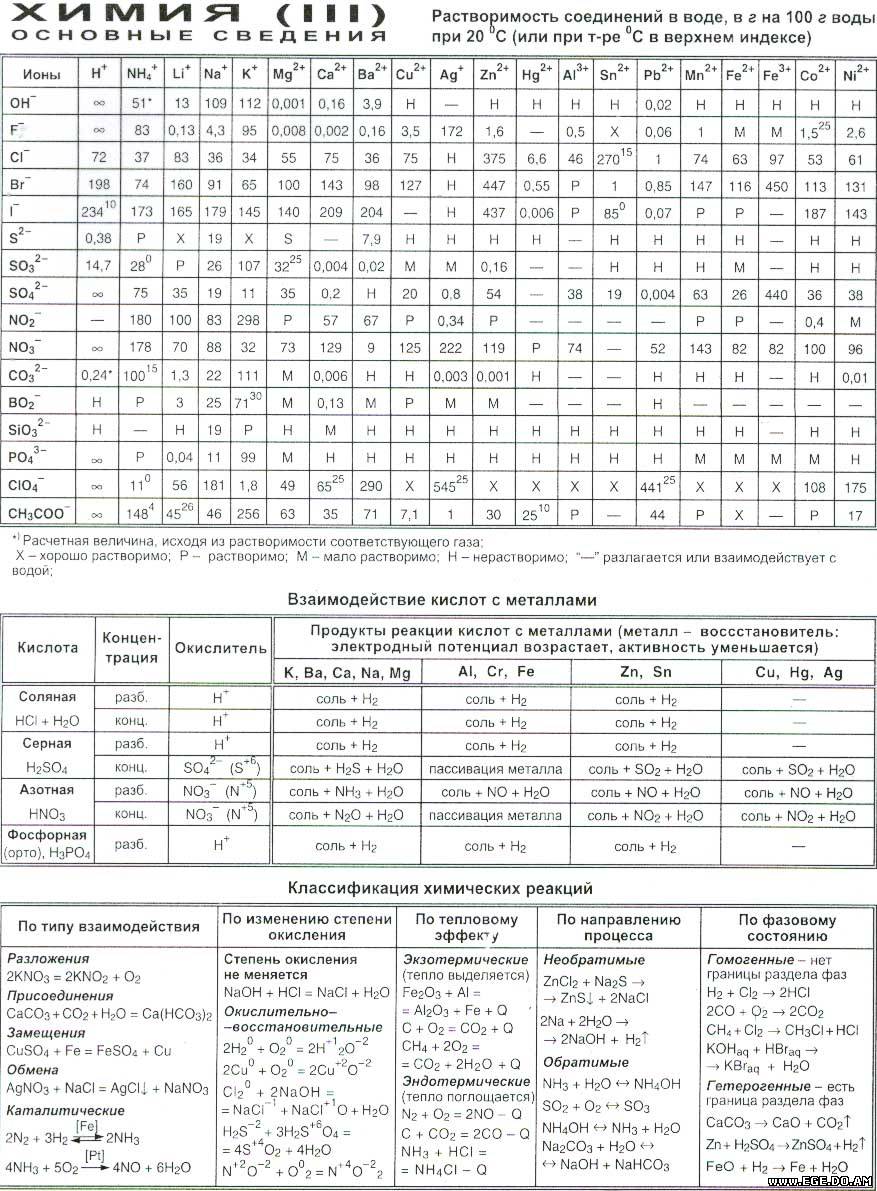
Признаки химических реакции
Говоря о химических реакциях, мы можем предположить, что каждая из них должна обладать определенными признаками, которые могут быть очень хорошо выражены, например взрыв, огонь или повышение температуры, либо быть менее явными: изменение цвета раствора, выделение газа, выпадение осадка. Все это характерные, но необязательные признаки происходящих химических процессов. Есть очень много реакций, недоступных нашему глазу. К ним относятся все превращения в нашем мозге, желудке и других внутренних органах. Например, сейчас ты прочитал о признаках химических реакций, и в твоей голове произошло много чудесных превращений, благодаря которым ты будешь помнить эту информацию.
Обратимость химических процессов. Принцип Ле-Шателье
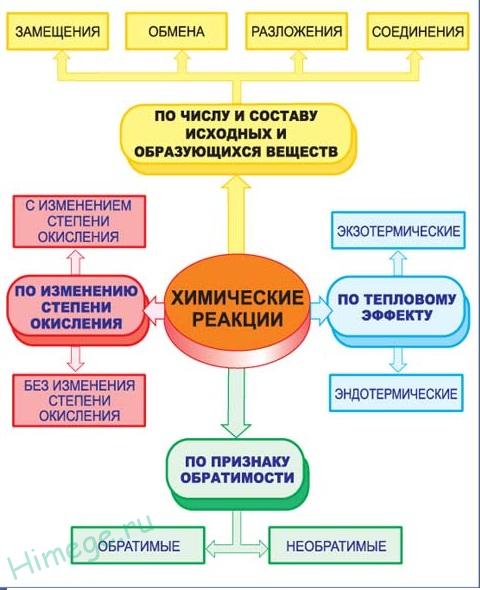
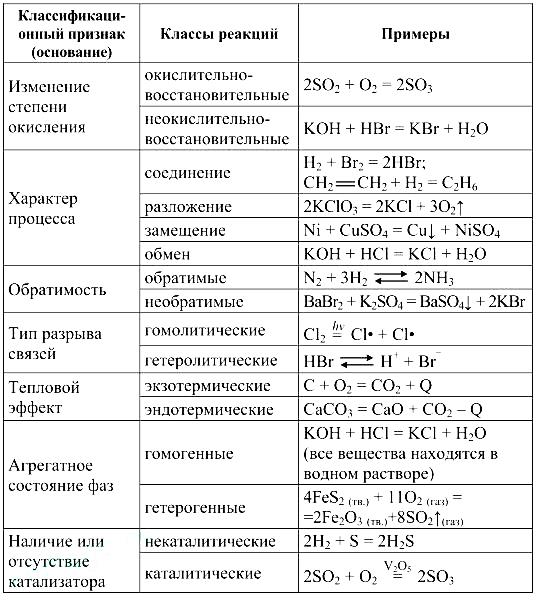
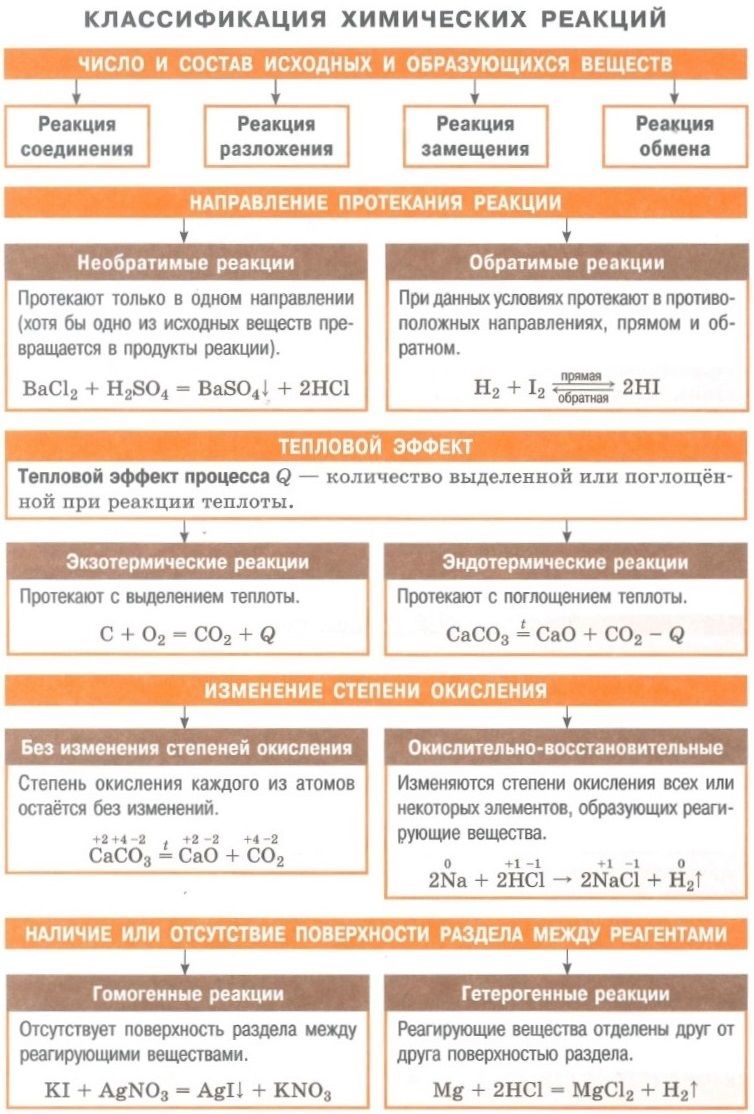
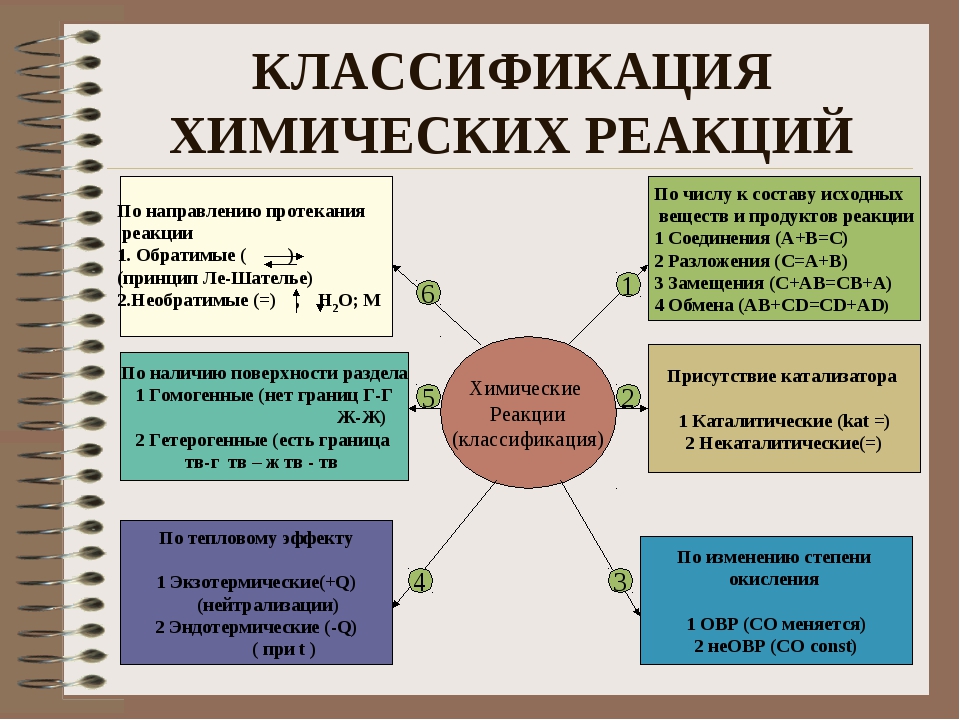
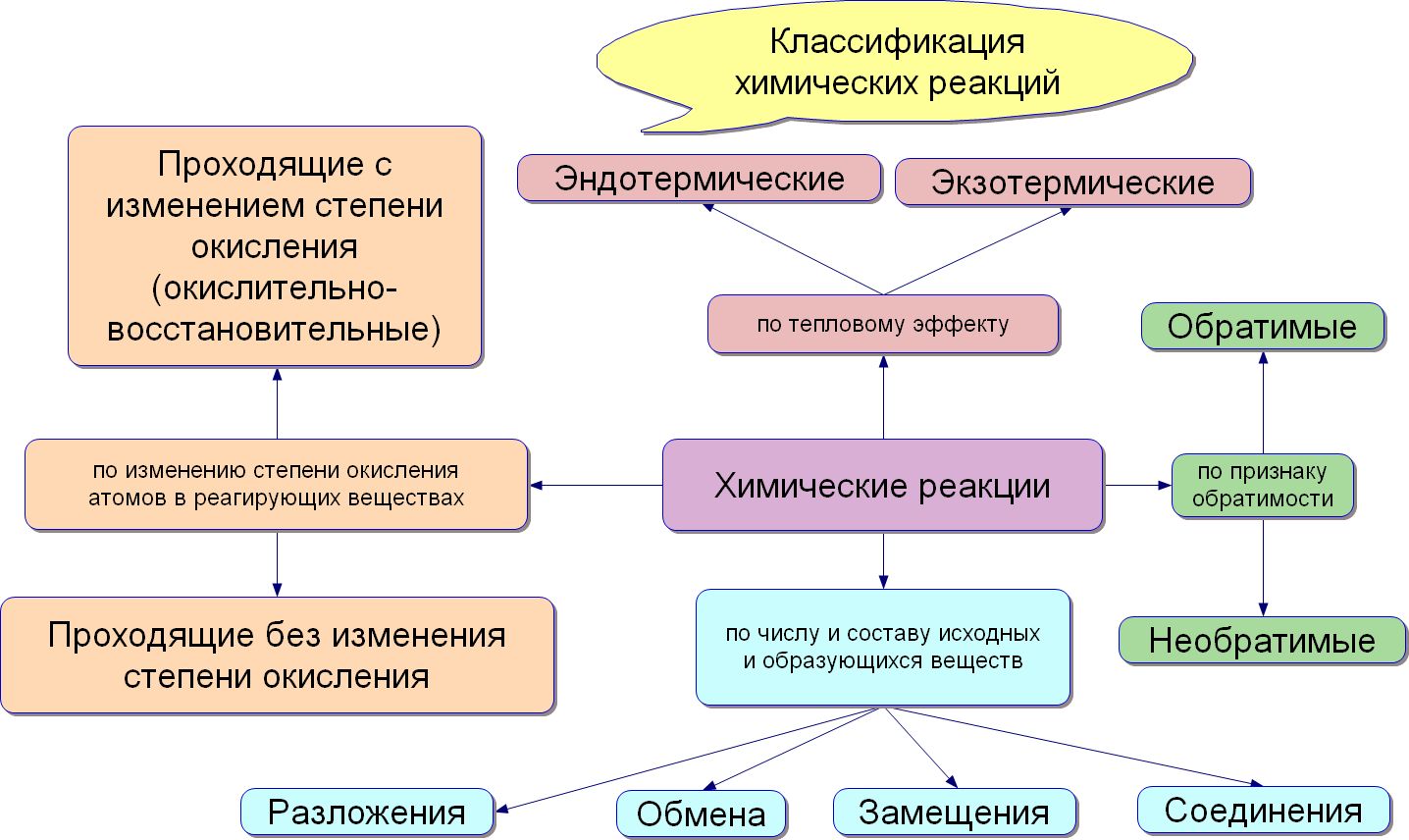
Реакции бывают обратимыми и необратимыми.
Необратимыми называют такие реакции, для которых не существует условий, при которых возможен обратный процесс.
Примером таких реакций могут служить реакции, которые происходят при скисании молока, или когда сгорела вкусная котлета. Как невозможно пропустить мясной фарш назад через мясорубку (и получить снова кусок мяса), также невозможно «реанимировать» котлету или сделать свежим молоко.
Но зададим себе простой вопрос: является ли необратимым процесс:
Для того чтобы ответить на этот вопрос, попробуем вспомнить, можно ли осуществить обратный процесс? Да! Разложение известняка (мела) с целью получить негашёную известь СаО используется в промышленном масштабе:
Таким образом реакция является обратимой, так как существуют условия, при которых с ощутимой скоростью протекают оба процесса:
Более того, существуют условия, при которых скорость прямой реакции равна скорости обратной реакции.

В этих условиях устанавливается химическое равновесие. В это время реакция не прекращается, но число полученных частиц равно числу разложившихся частиц. Поэтому в состоянии химического равновесия концентрации реагирующих частиц не изменяются. Например, для нашего процесса в момент химического равновесия
знак означает равновесная концентрация.
Возникает вопрос, что произойдёт с равновесием, если повысить или понизить температуру, изменить другие условия? Ответить на подобный вопрос можно, зная принцип Ле-Шателье:
если изменить условия (t, p, c), при которых система находится в состоянии равновесия, то равновесие сместится в сторону того процесса, который противодействует изменению.
Другими словами, равновесная система всегда противится любому воздействию извне, как противится воле родителей капризный ребёнок, который делает «всё наоборот».
Рассмотрим пример. Пусть установилось равновесие в реакции получения аммиака:
Вопросы. Одинаково ли число молей реагирующих газов до и после реакции? Если реакция идёт в замкнутом объёме, когда давление больше: до или после реакции?
Очевидно, что данный процесс происходит с уменьшением числа молекул газов, значит, давление в ходе прямой реакции уменьшается. В обратной реакции — наоборот, давление в смеси увеличивается.
Зададим себе вопрос, что произойдёт, если в этой системе повысить давление? По принципу Ле-Шателье пойдёт та реакция, которая «делает наоборот», т. е. понижает давление. Это — прямая реакция: меньше молекул газа — меньше давление.
Итак, при повышении давления равновесие смещается в сторону прямого процесса, где давление понижается, так как уменьшается число молекул газов.
Задание ЕГЭ. При повышении давления равновесие смещается вправо в системе:

Если в результате реакции число молекул газов не меняется, то изменение давления на положение равновесия не оказывает влияние.
Задание ЕГЭ. Изменение давления оказывает влияние на смещение равновесия в системе:
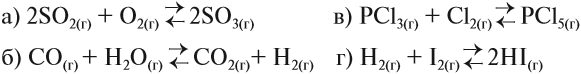
Положение равновесия этой и любой другой реакции зависит от концентрации реагирующих веществ: увеличивая концентрацию исходных веществ и уменьшая концентрацию полученных веществ, мы всегда смещаем равновесие в сторону прямой реакции (вправо).
Задание ЕГЭ. Химическое равновесие в системе
сместится влево при:
- повышении давления;
- понижении температуры;
- повышении концентрации СО;
- понижении концентрации СО.
Процесс синтеза аммиака экзотермичен, то есть сопровождается выделением теплоты, то есть повышением температуры в смеси.
Вопрос. Как сместится равновесие в этой системе при понижении температуры?
Рассуждая аналогично, делаем вывод: при понижении температуры равновесие сместится в сторону образования аммиака, так как в этой реакции теплота выделяется, а температура повышается.
Вопрос. Как изменится скорость химической реакции при понижении температуры?
Очевидно, что при понижении температуры резко понизится скорость обеих реакций, т. е. придётся очень долго ждать, когда же установится желаемое равновесие. Что делать? В этом случае необходим катализатор. Он хотя и не влияет на положение равновесия, но ускоряет наступление этого состояния.
Задание ЕГЭ. Химическое равновесие в системе
смещается в сторону образования продукта реакции при:
- повышении давления;
- повышении температуры;
- понижении давления;
- применении катализатора.

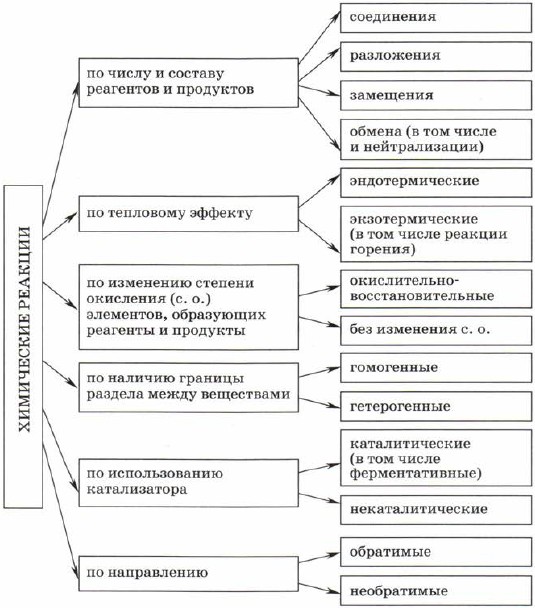
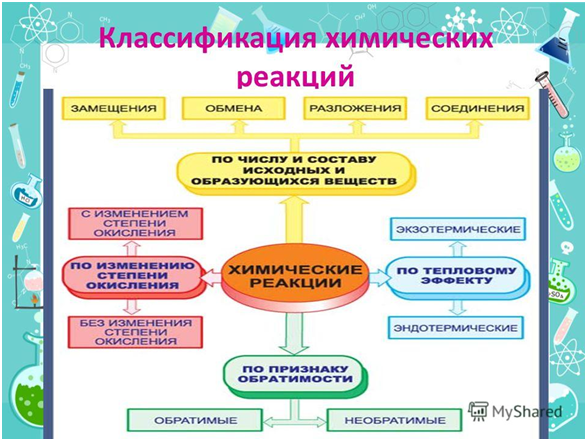
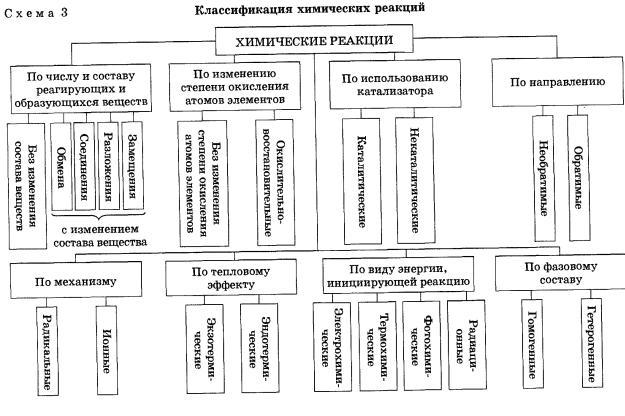
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
В органической химии к таким реакциям относятся реакции изомериза-ции, когда из одного изомера под действием катализатора и внешних факторов получается другой (как правило, структурный изомер).
Например, изомеризация бутана в 2-метилпропан (изобутан):
CH3-CH2-CH2-CH3 → CH3-CH(CH3)-CH3.
2. Реакции, протекающие с изменением состава
Реакции соединения (A + B + … → D) — это такие реакции, в которых из двух и более веществ образуется одно новое сложное вещество. В неорганической химии к реакция соединения относятся реакции горения простых веществ, взаимодействие основных оксидов с кислотными и др. В органической химии такие реакции называются реакциями присоединения. Реакции присоединения — это такие реакции, в ходе которых к рассматриваемой органической молекуле присоединяется другая молекула. К реакциям присоединения относятся реакции гидрирования (взаимодействие с водородом), гидратации (присоединение воды), гидрогалогенирования (присоединение галогеноводорода), полимеризация (присоединение молекул друг к другу с образованием длинной цепочки) и др.
Например, гидратация :
CH2=CH2 + H2O → CH3-CH2-OH
Реакции разложения (A → B + C + …) — это такие реакции, в ходе которых из одной сложной молекулы образуется несколько менее сложных или простых веществ. При этом могут образовываться как простые, так и сложные вещества.
Например, при разложении пероксида водорода:
2H2O2 → 2H2O + O2.
В органической химии разделяют собственно реакции разложения и реакции отщепления. Реакции отщепления (элиминирования) — это такие реакции, в ходе которых происходит отрыв атомов или атомных групп от исходной молекулы при сохранении ее углеродного скелета.
Например, реакция отщепления водорода (дегидрирование) от пропана:
C3H8 → C3H6 + H2
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
Например, реакция крекинга бутана (расщепление на более простые молекулы при нагревании или под действием катализатора):
C4H10 → C2H4 + C2H6
Реакции замещения — это такие реакции, в ходе которых атомы или группы атомов одного вещества замещаются на атомы или группы атомов другого вещества. В неорганической химии эти реакции происходят по схеме:
AB + C = AC + B.
Например, более активные галогены вытесняют менее активные из соединений. Взаимодействие йодида калия с хлором:
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
Например, при сплавлении менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид углерода из карбоната натрия при сплавлении:
Na2CO3 + SiO2 → Na2SiO3 + CO2
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
Например, реакция хлорирования метана:
CH4 + Cl2 → CH3Cl + HCl
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
Реакции обмена — это такие реакции, в ходе которых два сложных вещества обмениваются своими составными частями:
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
CH3-CH2-Cl + KOH = CH3-CH2-OH + KCl
Химия
Фундаментальная операция, посредством которой создаются новые вещества, химическая реакция состоит в трансформации материи. При этом атомы молекул реагентов разделяются, а затем перестраиваются, чтобы создать новые молекулы, которые составляют продукты реакции. Перед началом реакции необходимо задуматься, будут ли вещества, вступающие в контакт, реагировать с образованием ожидаемых продуктов. Большинство химических реакций протекают в благоприятном направлении. В некоторых случаях происходит противоположное желаемой реакции! Решение этой проблемы требует использования знаний по химической термодинамики.
Когда реакция «возможна» — тогда она имеет тенденцию происходить спонтанно в заданном направлении — важно знать ее скорость. Это обуславливает переход из лаборатории в промышленное производство, которое должно функционировать бесперебойно и без преждевременных реакций
Литература
- Эмануэль Н. М., Кнорре Д. Г. Курс химической кинетики. — 4-е изд., переработанное и дополненное. — М.: Высшая школа, 1984. — 463 с.
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989.
- Басоло Ф., Пирсон Р. Механизмы неорганических реакций. — М.: Мир, 1971. — 591 с.
- Воронин А. И., Ошеров В. И., Динамика молекулярных реакций. М.: Наука, 1990. — 421с.
- Ганкин В. Ю., Ганкин Ю. В., Как образуется химическая связь и протекают химические реакции. М.: Граница, 2007.-319 с.
- Никитин Е. Е., Теория элементарных атомно-молекулярных процессов в газах. М., Химия, 1970.
- Тоуб М. Механизмы неорганических реакций. — М.: Мир, 1975. — 275 с.
- Глесстон С., Лейдлер К., Эйринг Г. Теория абсолютных скоростей реакций. М.: ГИИЛ, 1948. — 584 с.
- Уманский С. Я. Теория элементарных химических реакций. Интеллект, 2009. — 408с.
Реакции двойного замещения
В реакциях двойного замещения происходит замещение уже двух электронов. Такие реакции еще называют реакциями обмена. Такие реакции проходят в растворе с образованием:
- нерастворимого твердого вещества (реакции осаждения);
- воды (реакции нейтрализации).
Реакции осаждения
При смешивании раствора нитрата серебра (соль) с раствором хлорида натрия образуется хлорид серебра:
Молекулярное уравнение: KCl(р-р) + AgNO3 (p-p) → AgCl(т) + KNO3 (p-p)
Ионное уравнение: K+ + Cl- + Ag+ + NO3— → AgCl(т) + K+ + NO3—
Молекулярно-ионное уравнение:
Cl- + Ag+ → AgCl(т)
Если соединение растворимое, оно будет находиться в растворе в ионном виде. Если соединение нерастворимое, оно будет осаждаться, образовывая твердое вещество.
Растворимые ионные соединения:
|
Нерастворимые ионные соединения:
|
Реакции нейтрализации
Это реакции взаимодействия кислот и оснований, в результате которых образуются молекулы воды.
Например, реакция смешивания раствора серной кислоты и раствора гидроксида натрия (щелока):
Молекулярное уравнение:
H2SO4 (p-p) + 2NaOH(p-p) → Na2SO4 (p-p) + 2H2O(ж)
Ионное уравнение:
2H+ + SO42- + 2Na+ + 2OH- → 2Na+ + SO42- + 2H2O(ж)
Молекулярно-ионное уравнение:2H+ + 2OH- → 2H2O(ж) или H+ + OH- → H2O(ж)
Литература
- Эмануэль Н. М., Кнорре Д. Г. Курс химической кинетики. — 4-е изд., переработанное и дополненное. — М.: Высшая школа, 1984. — 463 с.
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989.
- Басоло Ф., Пирсон Р. Механизмы неорганических реакций. — М.: Мир, 1971. — 591 с.
- Воронин А. И., Ошеров В. И., Динамика молекулярных реакций. М.: Наука, 1990. — 421с.
- Ганкин В. Ю., Ганкин Ю. В., Как образуется химическая связь и протекают химические реакции. М.: Граница, 2007.-319 с.
- Никитин Е. Е., Теория элементарных атомно-молекулярных процессов в газах. М., Химия, 1970.
- Тоуб М. Механизмы неорганических реакций. — М.: Мир, 1975. — 275 с.
- Глесстон С., Лейдлер К., Эйринг Г. Теория абсолютных скоростей реакций. М.: ГИИЛ, 1948. — 584 с.
- Уманский С. Я. Теория элементарных химических реакций. Интеллект, 2009. — 408с.
Реакции одинарного замещения
В результате реакций одинарного замещения, более активный элемент замещает в соединении менее активный:
Zn(т) + CuSO4 (р-р) → ZnSO4 (р-р) + Cu(т)
Цинк в растворе сульфата меди вытесняет менее активную медь, в результате чего образуется раствор сульфата цинка.
Степень активности металлов по возрастанию активности:
- Au
- Ag
- Cu
- Pb
- Sn
- Ni
- Fe
- Cr
- Al
- Наиболее активными являются щелочные и щелочноземельные металлы
Ионное уравнение вышеприведенной реакции будет иметь вид:
Zn(т) + Cu2+ + SO42- → Zn2+ + SO42- + Cu(т)
Ионная связь CuSO4 при растворении в воде распадается на катион меди (заряд 2+) и анион сульфата (заряд 2-). В результате реакции замещения образуется катион цинка ( который имеет такой же заряд, как и катион меди: 2-)
Обратите внимание, что анион сульфата присутствует в обеих частях уравнения, т.е., по всем правилам математики его можно сократить. В итоге получится ионно-молекулярное уравнение:
Zn(т) + Cu2+ → Zn2+ + Cu(т)
Применение
С помощью химических реакций можно получать практически любые вещества, которые в природе находятся в ограниченных количествах, например, азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
Литература
- Эмануэль Н. М., Кнорре Д. Г. Курс химической кинетики. — 4-е изд., переработанное и дополненное. — М.: Высшая школа, 1984. — 463 с.
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989.
- Басоло Ф., Пирсон Р. Механизмы неорганических реакций. — М.: Мир, 1971. — 591 с.
- Воронин А. И., Ошеров В. И., Динамика молекулярных реакций. М.: Наука, 1990. — 421с.
- Ганкин В. Ю., Ганкин Ю. В., Как образуется химическая связь и протекают химические реакции. М.: Граница, 2007.-319 с.
- Никитин Е. Е., Теория элементарных атомно-молекулярных процессов в газах. М., Химия, 1970.
- Тоуб М. Механизмы неорганических реакций. — М.: Мир, 1975. — 275 с.
- Глесстон С., Лейдлер К., Эйринг Г. Теория абсолютных скоростей реакций. М.: ГИИЛ, 1948. — 584 с.
- Уманский С. Я. Теория элементарных химических реакций. Интеллект, 2009. — 408с.
Реакции соединения
В реакциях соединения хотя бы два элемента образуют один продукт:
2Na(т) + Cl2 (г) → 2NaCl(т) — образование поваренной соли.
Следует обратить внимание на существенный нюанс реакций соединения: в зависимости от условий протекания реакции или пропорций реагентов, вступающих в реакцию, — ее результатом могут быть разные продукты. Например, при нормальных условиях сгорания каменного угля получается углекислый газ:C(т) + O2 (г) → CO2 (г). Если же количество кислорода недостаточно, то образуется смертельно опасный угарный газ:2C(т) + O2 (г) → 2CO(г)
Если же количество кислорода недостаточно, то образуется смертельно опасный угарный газ:2C(т) + O2 (г) → 2CO(г)
Признаки химических реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Физические явления
Нальем воду в колбу и нагреем ее до кипения. Каждый из вас знает, что при кипении вода превращается в пар, т. е. переходит в другое агрегатное состояние. Однако несложно доказать, что вода и пар — это одно и то же вещество. Подумайте, как это можно сделать.
Нагреем тонкую стеклянную трубку в пламени спиртовки. Стекло станет мягким, и мы легко изменим форму трубки, но стекло как вещество остается тем же.
Эти явления физические. При физических явлениях не происходит образования новых веществ. Изменяется только агрегатное состояние веществ, их форма, а состав веществ остается прежним (рис. 48).
Например, вода — это вещество, которое в природе образует не только реки, моря, но и ледники, и облака. Ледники тают, облака роняют капли воды, вода испаряется, т. е. происходит изменение ее агрегатного состояния, но состав молекул остается неизменным.

Сгибание проволоки, дробление соли, плавление металлов (рис. 49), образование мраморной крошки, перемалывание зерна в муку, превращение воды в пар при кипячении — все это физические явления. Они осуществляются в результате деятельности человека. У веществ при этом изменяется только форма или агрегатное состояние.

Физическими называются явления, при которых изменяется только форма или агрегатное состояние веществ.
Виды реакций
Виды реакций:Все химические реакции подразделяют на простые и сложные. Простые химические реакции, в свою очередь, обычно подразделяют на четыре типа: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно. Примером химической реакции соединения может служить нагревание порошков железа и серы, — при этом образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода,…) на воздухе. Например, углерод горит на воздухе С+О2=СО2 (конечно эта реакция протекает постепенно, сначала образуется угарный газ СО). Реакции горения всегда сопровождаются выделением тепла — являются экзотермическими.
Химические реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Примером реакции разложение меже служить химическая реакция разложения мела (или известняка под воздействием температуры): СаСО3→ СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов. Если взаимодействуют простое вещество и сложное —то эта химическая реакция называется химической реакцией замещения: Например опустив стальной гвоздь в раствор медного купороса получаем железный купорос (здесь железо вытеснило медь из её соли) Fe+CuSO4→ FeSO4+Cu.
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к химическим реакциям обмена. Большое их число протекает в водных растворах. Примером химической реакции обмена может служить нейтрализация кислоты щёлочью: NaOH+HCl→ NaCl+Н2О.
Здесь в реагентах (веществах, стоящих слева) ион водорода из соединения HCl обменивается с ионом натрия из соединения NaOH, в результате чего образуется раствор поваренной соли в воде
Типы реакций и их механизмы приведены в таблице:
|
химические реакции соединения A + B = AB Пример:S + O2→ SO2 Из нескольких простых или сложных веществ образуется одно сложное |
химические реакции разложения AB = A + B Пример:2HN3→ H2 + 3N2 Из сложного вещества образуется несколько простых или сложных веществ |
химические реакции замещения A + BC =AC + B Пример:Fe + CuSO4→ Cu + FeSO4 Атом простого вещества замещает один из атомов сложного |
химические реакции ионного обмена AB+CD = AD+CB Пример:H2SO4 + 2NaCl→ Na2SO4 + 2HCl Сложные вещества обмениваются своими составными частями |
Однако очень многие реакции не укладываются в приведённую простую схему. Например, химическая реакция между перманганатом калия (марганцовкой) и иодидом натрия не может быть отнесена ни к одному из указанных типов. Такие реакции, обычно, называют окислительно — восстановительные реакции, например:
2KMnO4+10NaI+8H2SO4→ 2MnSO4+K2SO4+5Na2SO4+5I2+8H2O.
Условия протекания химических реакций
Необходимое и главное условие для протекания большинства реакций между различными веществами — это их соприкосновение. Для обеспечения лучшего контакта вещества измельчают, переводят в газообразное состояние. Многие вещества лучше реагируют друг с другом, если они растворены в воде.
Во многих случаях этого недостаточно, поэтому реагирующие вещества нагревают. Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
Мало знать, как начать химическую реакцию, надо еще знать, при каких условиях она будет протекать дальше. Почему необходимо все время нагревать сахар, чтобы добиться его полного сгорания, а деревянную лучинку зажигают один раз и она продолжает гореть?
Если при образовании новых веществ выделяется много теплоты, то ее бывает достаточно, чтобы нагревались новые порции вещества и реакция продолжалась. Во многих случаях реакции, начавшись, продолжаются за счет теплоты, выделяемой в этих реакциях, не требуя дополнительной энергии. Примером является горение угля. Другие реакции, например разложение сахара, требуют постоянной затраты энергии на ее продолжение.
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза.
Таким образом, окружающий нас мир состоит из множества веществ, которые вступают в различные химические реакции. Изучая химические реакции, человек познает сущность процессов, протекающих в живой и неживой природе. Полученные знания помогают более эффективно использовать вещества для получения больших урожаев, выращивания животных, борьбы с различными болезнями. Человечество учится бережно и грамотно относиться к окружающему нас миру.
Краткие выводы урока:
- Химические реакции — это явления превращения одних веществ в другие.
- О протекании химических реакций судят по выделению газа, выпадению или исчезновению осадка, изменению цвета, появлению запаха, поглощению или выделению теплоты и излучению света.
- Необходимым условием протекания большинства химических реакций является соприкосновение реагирующих веществ.
Надеюсь урок 10 «Признаки химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.