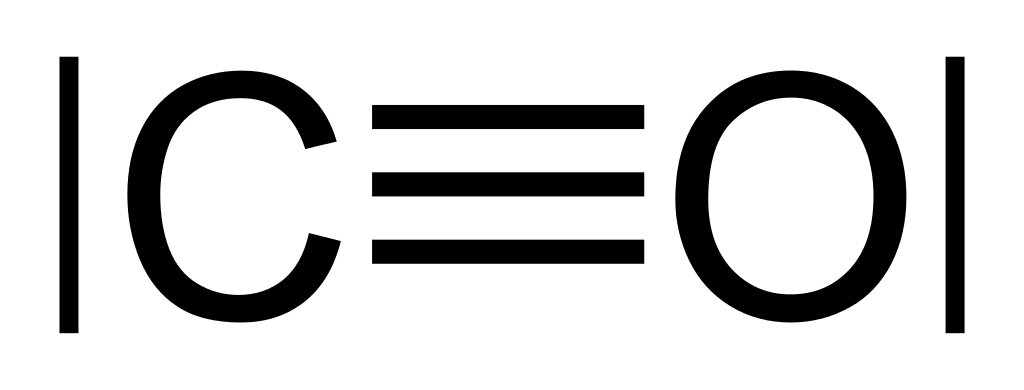
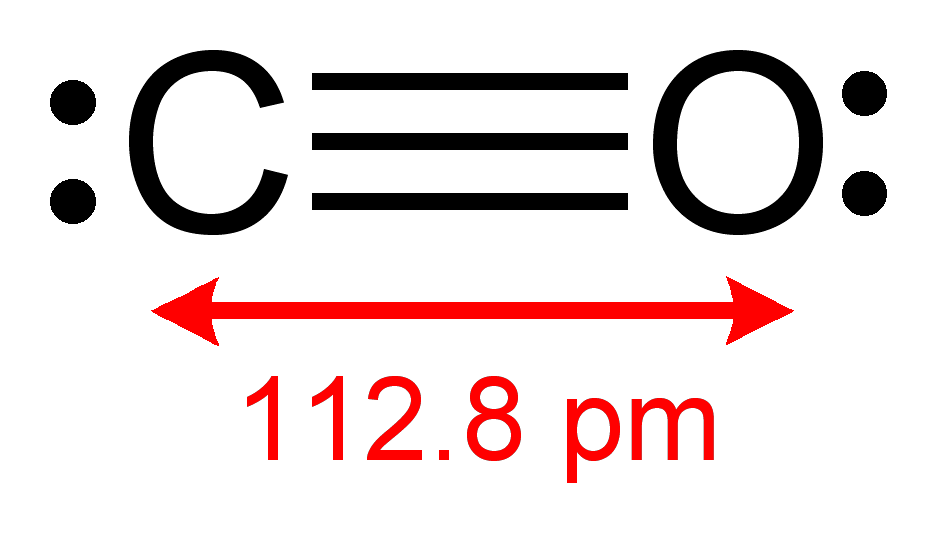
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO₂ в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO₂ (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе.
Изменения концентрации атмосферного углекислого газа (кривая Килинга). Измерения в обсерватории на горе Мауна-Лоа, Гавайи.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон.
Большое количество углекислоты растворено в океане.
[править] Химические свойства
На воздухе он загорается при 700° C и горит характерным голубым пламенем с образованием диоксида углерода:
2CO + O2 = 2CO2 + 565 кДж
При этом выделяется значительное количество тепла (135 ккал или 565т кДж). Поэтому CO в смеси с другими газами применяют в технике как газообразное топливо (доменные газы, генераторный газ, водяной газ и т. д.).
При высокой температуре монооксид углерода проявляет восстановительные свойства, благодаря чему широко используется в металлургии для получения некоторых металлов из их оксидов. К примеру:
- PbO + CO = Pb + CO2↑
- Fe2O3 + 3CO = 2Fe + 3CO2↑
Хотя некоторые благородные металлы может восстанавливать из водных растворов их солей и при комнатной температуре:
При присоединении хлора к монооксиду углерода образуется фосген. Реакция происходит в присутствии активированного угля в качестве катализатора даже при комнатной температуре:
Газ может напрямую присоединиться к некоторым металлам с образованием карбонилов металлов (например, Fe(CO)5, Ni(CO)4, Mo(CO)6, Cr(CO)6 и т. д.). Такие реакции обычно проходят при повышенной температуре и давлении:
Fe + 5CO = Fe(CO)5
Поскольку обычные противогазы монооксид углерода практически не задерживают, в 1917 году были разработаны насадки со смесью оксида меди с двуокисью марганца (так называемые гопкалиты) способны окислить монооксид до двуокиси углерода при обычных температурах (в начале работы при окислении оксида они нагреваются за счет теплоты, выделяющейся в результате реакции).
Углекислый газ[править | править код]
Транспорт углекислого газаправить | править код
Углекислый газ образуется в процессе обмена веществ примерно в таком же количестве, в каком потребляется кислород. В покое это количество равно примерно 3 мл/мин/кг, а при тяжелой физической нагрузке может резко увеличиваться. Углекислый газ легко диффундирует из клеток в кровь. Здесь он частично растворяется в Плазме, частично превращается в бикарбонат и, наконец, частично связывается с гемоглобином и белками плазмы. РСО2 в смешанной венозной крови равно примерно 6 кПа (46 мм рт. ст). Далее углекислый газ переносится в легкие и удаляется с выдыхаемым воздухом. Скорость удаления углекислого газа равна скорости его образования. В альвеолах и артериальной крови РСО2 равно 5,2 кПа (40 мм рт. ст.). Повышение РαСО2 вызывает дыхательный ацидоз. Это состояние может возникать при гиповентиляции или вдыхании углекислого газа. Напротив, при гипервентиляции возникает снижение РαСО2 и дыхательный алкалоз. Поскольку углекислый газ легко диффундирует, то изменение РαСО2 и pH крови вскоре приводит к изменению РСО2 и pH в клетках.
Физиологические эффекты углекислого газаправить | править код
Изменение РСО2 и pH крови влияет на функцию многих систем — особенно дыхательной, сердечно-сосудистой и ЦНС (подробнее см. руководства по физиологии, например Nunn, 1993а).
Дыхательная система. Углекислый газ оказывает быстрое и выраженное действие на легочную вентиляцию. Это действие находится в прямой зависимости от его концентрации во вдыхаемой смеси. Ингаляция 10% углекислого газа вызывает увеличение МОД до 75 л/мин. Углекислый газ оказывает стимулирующее действие на дыхание через центральные (в продолговатом мозге) и периферические (в аортальных и каротидных тельцах) хеморецепторы. Импульсы от них идут к дыхательным нейронам в стволе мозга. Действие углекислого газа на хеморецепторы, по-видимому, опосредовано изменением pH (Nattie, 1999; Drysdale et al., 1981). Повышение PCО2 вызывает бронходилатацию, а снижение — наоборот. Возможно, этот эффект играет роль в поддержании вентиляционно-перфузионного отношения (Duane et al., 1979).
Сердечно-сосудистая система. Углекислый газ оказывает на кровообращение как прямое (местное), так и центральное (обусловленное изменением активности вегетативных нервов) действие. Прямое действие углекислого газа на сердце приводит к снижению сократимости в результате изменения pH (van den Bos et al., 1979); прямое действие на сосуды сопровождается их расширением. Центральное же действие углекислого газа проявляется повышением симпатического тонуса и концентрации в крови адреналина, норадреналина, ангиотензина и других вазоактивных пептидов (Staszewska-Barczak and Dusting, 1981). Повышение симпатического тонуса вызывает увеличение частоты и силы сокращений сердца и сужение сосудов, то есть эффекты, противоположные местным.
Реакция сердечно-сосудистой системы на действие углекислого газа определяется соотношением между его прямым и центральным действием. Сердечный выброс, ЧСС и АД растут. В сосудах преобладает прямое действие углекислого газа, проявляющееся в их расширении и уменьшении ОПСС. Углекислый газ вызывает выраженное расширение коронарных сосудов (Ely etal., 1982). Аритмогенное действие гиперкапнии обусловлено высвобождением катехоламинов.
Гипокапния оказывает противоположное действие: АД снижается, а сосуды кожи, кишечника, головного мозга, почек и сердца сужаются. Это действие гипокапнии используют в клинике, например проводят ИВЛ с гипервентиляцией при внутричерепной гипертензии.
ЦНС. При гиперкапнии снижается возбудимость коры головного мозга и (также за счет центрального действия углекислого газа) порог болевой чувствительности кожи
Тормозящее действие углекислого газа на ЦНС имеет важное клиническое значение. Так, при гиповентиляции, вызванной средствами для общей анестезии или наркотическими анальгетиками, накапливающийся углекислый газ через тормозящее влияние на ЦНС может вызвать еще большее угнетение дыхательного центра.
В результате образуется порочный круг, способный стать причиной смерти. Ингаляция газовой смеси с высокой концентрацией углекислого газа (до 50%) вызывает выраженное угнетение коры головного мозга и подкорковых структур, напоминающее действие средств для общей анестезии. С другой стороны, при определенных условиях вдыхание углекислого газа в концентрации 25—30% может вызвать возбуждение подкорковых структур и эпилептические припадки.
Чем распылять СО?
- Рябиновые ветки образуют маленькие пузыри, но быстро загрязняются. Используется сухая веточка рябины (диаметр – 6 мм), срезанная наискось с одной стороны и прямо — с другой. Прямым срезом веточка вставляется в трубку подачи газа. Диффузор готов.
- Камешковые распылители дают крупные пузырьки, поэтому газ растворяется хуже.
- Колокол изготавливается чаще всего из прозрачного колпачка от дезодоранта. Можно купить в магазине. Это устройство задерживает углекислоту.
- Стеклянные диффузоры прекрасно работают в баллонной системе подачи газа и с системой на основе лимонной кислоты и содового раствора. Без труда его можно приобрести в специализированном магазине.
Получение в промышленности
Получение диоксида углерода в промышленности методологически разнообразно. Он находится в дымовых отходах, выпускаемых в атмосферу ТЭЦ и электростанциями, получается при брожении спирта и выступает как продукт реакции с природными карбонатами.

Индустрия получения двуокиси углерода широка. Газ можно абсорбировать несколькими способами из одного источника. Во всех случаях это поэтапный процесс очистки от примесей (для достижения требований ГОСТа) и достижения нужной консистенции, агрегатного состояния.
Получение газообразной двуокиси углерода
Газообразный CO2 извлекают из промышленных (нефтяных) дымов путем адсорбции моноэтаноламина (коммерчески выгодно) и карбонатом калия (редко). Принцип сбора частиц углерода одинаков для обоих веществ. Они направляются по трубопроводу к отходам и собирают в себя углекислый газ. После сбора, насыщенные углекислотой газы направляются на очистку.
В специальных емкостях происходит реакция в при повышенной температуре или заниженном давлении. В процессе высвобождается чистая углекислота и продукты распада (аммиак и другие).
 Установка добычи углекислоты
Установка добычи углекислоты
Схематически процесс выглядит так:
- Отходящий дым смешивается с адсорбентами (газообразным карбонатом калия или моноэтаноламином);
- Накопившие в себе двуокись углерода газы поступают в специальный газгольдер для очистки;
- В реакции с высокой температурой или низким давлением происходит отделение углекислого газа от адсорбента.
В лаборатории извлечь много CO2 не получается. Но это возможно в реакции с гидрокарбонатами и кислотами. В отдельности CO2 можно выделить на промышленных станках для получения кислорода, аргона или азота. Углекислый газ здесь выступает как побочный продукт. Хранится он в специальных баллонах, поставляемых потребителю.
Получение жидкой углекислоты
Добыча жидкой углекислоты поэтапно связана с получением ее из газа. Из летучего газообразного состояния, при обработке водородом, раствором перманганата калия и углем, образуется жидкая двуокись.
Сжижение происходит из-за низкого давления, сопровождающего реакцию. После многоступенчатой очистки, жидкий диоксид углерода попадает в компрессор. Там он сжимается и подается для сушки в 2 адсорбера, поочередно перенимающие работу для восстановления. Параллельно сжатая жидкость очищается от запахов и переводится в конденсатор, а оттуда – на хранение.
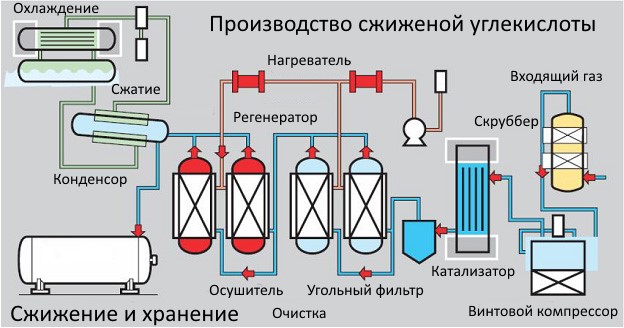
Этот метод сжижения применяется для газов спиртового брожения. Он актуален для пропана, бутана и т.д. Его используют на крупных пивоварнях, а получаемая очищенная углекислота имеет высокие показатели качества.
Получение твердого диоксида углерода
Твердый диоксид образуют из жидкого путем обработки низкой температурой (-56°). В промышленных условиях только 20% переходят в твердое состояние, а остальные – испаряются.
 Сухой лед
Сухой лед
Порядок извлечения углекислотных кристаллов (сухого льда):
- Из емкости брожения газ переходит в емкость для промывки;
- В газгольдере после мытья он сжимается и сжижается;
- Многократно сжимаясь и нагреваясь, газообразный углерод охлаждается в специальных холодильниках;
- Жидкость очищается активированным углем;
- Поступает в холодильник, где охлаждается и дополнительно очищается от примесей;
- Охлажденный CO2 направляется на испарение и пресс, где комплектуется сухой лед.
Лечебное применение углекислого газа[править | править код]
Ингаляцию углекислого газа в настоящее время назначают все реже из-за появления более эффективных методов лечения. Ее применяли для ускорения вводной анестезии и пробуждения после ингаляционной анестезии, так как под действием углекислого газа возрастают МОД и мозговой кровоток. Однако при ингаляции углекислого газа возникает более или менее выраженный дыхательный ацидоз. При проведении анестезии иногда вызывают, напротив, гипокапнию. Она приводит к дыхательному алкалозу, спазму мозговых сосудов и некоторому уменьшению объема мозга; это облегчает проведение нейрохирургических операций. Хотя углекислый газ стимулирует дыхание, его не следует применять в случаях, когда угнетение дыхания сопровождается гиперкапнией или ацидозом, — из-за опасности еще большего торможения дыхательного центра.
Углекислый газ обычно используют для вдувания в брюшную полость во время лапароскопических операций, так как он хорошо растворим в воде и не огнеопасен. При случайной эмболии пузырьки углекислого газа легко растворяются, и он выводится через легкие.
Недавно углекислый газ стали применять при операциях на открытом сердце для заполнения операционного поля. Благодаря большей плотности углекислый газ вытесняет воздух, окружающий сердце, так что любые пузырьки газа в полостях сердца вместо нерастворимого азота содержат углекислый газ (Na-dolny and Svensson, 2000). По тем же соображениям углекислый газ используют для удаления пузырьков воздуха из аппарата искусственного кровообращения и экстракорпорального мембранного оксигенатора. Его применяют также для коррекции pH во время коронарного шунтирования на фоне гипотермии.
Применение оксидов углерода в промышленности и их влияние на различные аспекты жизни
Оксиды углерода имеют очень широкое применение в разных сферах деятельности человека, причем спектр их чрезвычайно богат. Так, окись углерода вовсю применяется в металлургии в процессе выплавки чугуна. Широкую популярность CO получил в качестве материала для хранения продуктов питания в охлажденном виде. Данный оксид применяют для обработки мяса и рыбы, чтобы придать им свежий вид и не изменить вкус
Важно не забывать про токсичность данного газа и помнить, что допустимая доза не должна превышать 200 мг на 1 кг продукта. CO в последнее время все чаще применяют в автомобильной промышленности в качестве топлива для автомобилей на газу
Диоксид углерода нетоксичен, поэтому сфера его применения широко внедрена в пищевую промышленность, где его применяют в качестве консерванта или разрыхлителя. Также CO2 применяется при изготовлении минеральных и газированных вод. В твердом состоянии («сухой лед») он часто используется в морозильных установках для поддержания стабильно низкой температуры в помещении или приборе.
Большую популярность приобрели углекислотные огнетушители, пена из которых полностью изолирует огонь от кислорода и не дает пожару разгореться. Соответственно, еще одна сфера применения – пожарная безопасность. Баллоны в пневматических пистолетах также заряжены углекислотой. И конечно же, практически каждый из нас читал, из чего состоит освежитель воздуха для помещений. Да, одной из составляющих является углекислый газ.
Как видим, из-за своей минимальной токсичности углекислый газ больше и чаще встречается в повседневной жизни человека, тогда как угарный газ нашел применение в тяжелой промышленности.
Существуют и другие углеродные соединения с кислородом, благо формула углерода и кислорода позволяет применять различные варианты соединений с разным количеством атомов углерода и кислорода. Ряд оксидов может разниться от C2O2 до C32O8. И чтобы описать каждый из них, потребуется не одна страница.
Описание и история создания угарного газа
 Монооксид углерода – второе и научное название угарного газа. При средней температуре и нормальном давлении он легче атмосферного воздуха. У СО нет ни запаха, ни вкуса, поэтому обнаружить его очень сложно.
Монооксид углерода – второе и научное название угарного газа. При средней температуре и нормальном давлении он легче атмосферного воздуха. У СО нет ни запаха, ни вкуса, поэтому обнаружить его очень сложно.
В 1776 году химик из Франции Жак де Лассон провел научный опыт. Он нагрел уголь и оксид цинка, в результате чего и был получен монооксид углерода (СО). При сгорании он окрашивался в синий цвет, из-за чего был принят за водород.
В 1800 году в Англии ученый Вильям Крюйкшенк опытным путем выяснил, что в состав СО входят не только углерод, но и кислород. Во Франции в 1846 году были проведены опыты на собаках, целью которых стало исследование токсичности этого соединения.
Химико-физические свойства
При нагревании монооксид углерода проявляет ярко выраженные восстановительные свойства, однако при обычных условиях (отсутствие высокого давления и температуры) он не взаимодействует с водой, щелочью и кислотами.
При высоком давлении и температуре СО вступает в реакцию с некоторыми оксидами, восстанавливая их до металлов, а также с щелочами и водой. В результате такого взаимодействия получают различные вещества (муравьинокислый натрий, фосген, сероксид углерода и другие соединения).
Получение и применение
Угарный газ получают несколькими способами:
- Промышленный. При горении углеродистых соединений образуется дефицит кислорода, благодаря чему начинает выделяться угарный газ. В домашних условиях он образуется при сжигании дров в топке печи, если заслонка была закрыта рано. Также газ получают с помощью газогенераторов. Для этого водяной пар или воздух пропускают через слой раскаленного угля.
- Лабораторный. При этом способе газ получают с помощью горячей серной кислоты. Этим веществом воздействуют на муравьиную кислоту. Также СО выделяется во время нагревания смеси из щавелевой и серной кислот.
Угарный газ используют для получения некоторых органических спиртов. Он является основной составляющей водяного газа, который используется в качестве топлива для автомобилей с газогенераторными двигателями.
В пищевой промышленности такой газ используется для обработки рыбы и мяса. Он придает им привлекательный вид свежести красный оттенок, но при этом не изменяет вкусовых качеств продукта.
Врачебная помощь при отравлении угарным газом. Оказание доврачебной помощи при отравлении угарным газом
При остром отравлении угарным газом должны быть приняты следующие меры:
тот, кто оказывает помощь, должен надеть противогаз на себя и вынести пострадавшего из загазованной зоны на чистый воздух, а в холодное время года — в теплое помещение. Немедленно вызвать газоспасателей и скорую помощь по телефону 1-01; 1-03; 3-65;
обеспечить правильное кровообращение: уложить пострадавшего на спину, ровно, не запрокидывая голову и не сгибая шею, устранить в одежде все, что может в какой-то мере стеснять и затруднять свободное дыхание, расстегнуть ворот, брюки, юбку, снять ремень или пояс и.т.д.;
обеспечить достаточный приток свежего воздуха, открыть окно, обмахивать лицо, не допускать скопления людей вокруг пострадавшего. Давать нюхать нашатырный спирт, смочив им кусочек ваты, при этом не допускать попадания в глаза;
Если у пострадавшего дыхание редкое, судорожное, затрудненное или вообще отсутствует, необходимо немедленно подготовиться и приступить к производству искусственного дыхания.
Содержание в воздухе СО (окись углерода — угарный газ):
1 — 0,1% (1,25 мг/литр) через 1 час — головная боль, тошнота;
2 — 0,5% (6,25 мг/литр) через 20 минут — смертельное отравление;
3 — 1% (12,5 мг/литр) через 1-2 минуты сильное или смертельное отравление.
Допускаемая концентрация СО до 0,02%.
Окись углерода бесцветный газ, без вкуса, имеет слабый запах чеснока, горючий, взрывоопасный, немного легче воздуха, образуется в результате неполного сгорания газа и является сильнодействующим отравляющим газом.
Вдыхание воздуха, содержащего окись углерода выше предельно-допустимой концентрации, может привести к сильному отравлению и даже к смерти. При содержании в воздухе 12,5-75% по объему окиси углерода образуется взрывоопасная смесь.
Оксид углерода образуется:
при неправильной работе дымососа и вентилятора, если есть колебания величины разрежения в топке котла в связи с разрушением горелки, горелочного туннеля, нарушения процесса смесеобразования газа с воздухом.
при малой величине тяги в летний период у котлов с естественной тягой.
при открытии шиберов у неработающих котлов и, если у работающих котлов будет разная тяга.
при разрушении газоходов при попадании в них грунтовых вод, или воды из других коммуникаций.
при появлении течи из труб и других поверхностей нагрева.
при загорании сажи на поверхностях нагрева котлов, работающих на твердом или жидком топливе.
при нарушении приборов и регуляторов соотношений газ — воздух,
при возникновении разрежения в помещениях котельных, вследствие нарушения работы приточной вентиляции, когда забор воздуха происходит из котельной.
при нарушении плотности обмуровки и гарнитуры котла, работающих с наддувом в топке, и др. причины.
Действия на человека: СО связывается с гемоглобином крови и красные кровяные тельца становятся не способными переносить кислород от легких к другим тканям и органам, наступает кислородное голодание, удушье.
Симптомы: судороги, одышка, головная боль, туман перед глазами, потеря сознания.
Влияние угарного газа на организм человека
Оксид углерода в воздухе невозможно распознать, так как этот газ не имеет никакого ярко выраженного запаха. Именно этим он и опасен. Попадая через легкие в организм человека, угарный газ активизирует свою разрушительную деятельность в крови и в сотни раз быстрее кислорода начинает взаимодействовать с гемоглобином. В результате этого появляется очень стойкое соединение под названием карбоксигемоглобин. Оно препятствует доставке кислорода из легких к мышцам, что приводит к мышечному голоданию тканей. Особенно серьезно страдает от этого головной мозг.
Из-за отсутствия возможности распознать отравление угарным газом через обоняние, следует знать некоторые основные признаки, которые проявляются на ранних этапах:
- головокружение, сопровождающееся головной болью;
- шум в ушах и мерцание перед глазами;
- сильное сердцебиение и одышка;
- покраснение лица.
В дальнейшем у жертвы отравления появляется сильная слабость, иногда рвота. В тяжелых случаях отравления возможны непроизвольные судороги, сопровождающиеся дальнейшей потерей сознания и комой. Если же пациенту своевременно не будет оказана соответствующая медицинская помощь, то возможен летальный исход.